Електроди першого роду - Електрохімічні методи аналізу, електродний потенціал
Електроди цього типу складаються з металевої пластинки, зануреної в розчин однойменних катіонів. Вони оборотні відносно катіона або аніона і є двофазними. Схематично їх можна записати так;
Me | МN+
Наприклад, Zn | Zn2+, Си І Си2+.
Електродні реакції в таких напівелементах відповідають реакціям окиснення, якщо електрод негативний:
Me МеП+ + nе?,
Або реакціям відновлення, якщо електрод позитивний:
МеN+ + nе? Me.
Таким чином, на електродах першого роду відбувається процес переходу катіонів з металу в розчин або навпаки, тобто ці електроди оборотні відносно катіона.
Електроди другого роду складаються з металу, покритого його малорозчинною сполукою (сіллю, оксидом, гідроксидом) і зануреного в розчин добре розчинної сполуки з тим самим аніоном. Схематично ці електроди зображають так: Ме | Ме А, АN?.
Електроди другого роду оборотні відносно катіона і аніона.
Серед електродів другого роду найширшого застосування набули хлоро-срібний та каломельний електроди.
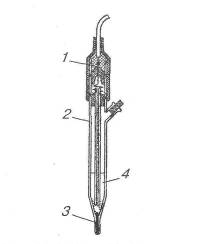
Рис. 4. Хлорсрібний електрод
Хлоросрібний електрод складається зі срібної дротини з нанесеним на неї шаром аргентум хлориду, зануреної в розчин КС1:
AglAgCl, KCl
Розглянемо електрохімічні процеси, що відбуваються у хлоросрібному електроді. Аргентум хлорид дисоціює з утворенням йонІв Ag+ та Сl?:
AgCI Ag+ + Сl?.
У присутності калій хлориду розчинність AgCI зменшується. Таким чином, при заданих концентрації КСl і температурі концентрація йонів Ag+ є величиною сталою, чим власне й забезпечується необхідна постійність потенціалу хлоросрібного електрода. На електроді встановлюється рівновага:
AgCI + е? Ag+ + Сl?.
Потенціал у хлоросрібному електроді виникає на поверхні стикання срібної пластинки з розчином йонів Аргентуму.
У насиченому розчині КС1 потенціал хлоросрібного електрода дорівнює +0,22 В і в електрохімічних дослідженнях його використовують як електрод порівняння.
Каломельний електрод складається з ртуті, покритої шаром каломелі Hg2Cl2 (малорозчинна сіль).
Ця система знаходиться у контакті з розчином калій хлориду певної концентрації:
Hg | Hg2Cl2, KCl.
На електроді відбувається реакція:
Hg2Cl2 + 2E? 2Hg + 2Сl?.
Потенціал каломельного електрода залежить тільки від активності хлорид-іонів у розчині.
Каломельний електрод при заданій концентрації йонів Хлору (тобто концентрації КС1) має постійний потенціал і його використовують як електрод порівняння. У насиченому розчині КС1 за температури 298 К його потенціал дорівнює +0,25 В.
До електродів другого роду належать також металоксидні електроди, наприклад:
Стибієвий - Sb | Sb2O3, ОН? та ртуть-оксидний - Hg | HgO, OH?.
Потенціали цих електродів залежать від концентрації йонів Гідрогену і тому їх можна застосовувати для вимірювання рН розчинів.
Похожие статьи
-
Електродний потенціал - Електрохімічні методи аналізу, електродний потенціал
Якщо занурити металеву пластинку у чисту воду, то йони, які містяться у вузлах кристалічної решітки металу, будуть гідратуватись полярними молекулами...
-
Електрохімічні методи засновані на використанні іонообмінних або електрообмінних процесах, що проходять на поверхні електроду або у приелектродному...
-
В залежності від якостей речовин, що використовуються для визначень, виділяють такі методи інструментального аналізу: 1) оптичні (визначення оптичних...
-
Складемо симплексну таблицю для першого опорного плану задачі. Елементи останнього рядка симплекс-таблиці є оцінками j, за допомогою яких опорний план...
-
Хроматографічні методи аналізу - Теоретичні основи аналітичної хімії
Хроматографічний метод - метод розділення та аналізу суміші речовин, заснований на відмінному розподілі їх між двома не змішуваними фазами - рухомій і...
-
Основні методи гравіметричного аналізу - Теоретичні основи аналітичної хімії
Від чіткого розділення досліджуваної речовини залежить весь аналіз. Осад повинен бути чистим і без домішок. Звичайно, в процесі роботи осад захоплює з...
-
Кореляційно-регресивний аналіз - це класичний метод стохастичного моделювання господарської діяльності. Він вивчає взаємозв'язки показників господарської...
-
В даний час найбільшу увагу в питаннях дослідження забруднення навколишнього середовища приділяється аналізу природних і стічних вод. ГХ-МС з он-лайн...
-
Поняття про мас-спектроскопічний метод аналізу - Гібридні методи. Газова хромато-мас-спектрометрія
Мас-спектроскопія - метод дослідження речовини шляхом визначення мас іонів цієї речовини (частіше відношення мас іонів до їхніх зарядів) і їхніх...
-
Кореляційний і регресивний методи аналізу зв'язку
Кореляційний і регресивний Методи аналізу зв'язку Основне завдання кореляційного і регресійного методів полягає в аналізі статистичних даних для...
-
ВСТУП - Кількісні методи аналізу та їх використання для прийняття управлінських рішень
Кількісні, техніко-економічні економіко-математичні, методи особливо збагатили арсенал прийомів економічного аналізу господарської діяльності. Їх широке...
-
, I=1,2,3,...,n, Де P J ? 1 - ваговий коефіцієнт J -го вихідного показника. Розташовуючи значення показника ПJ В порядку зростання, можна визначити...
-
Основні методи кількісного аналізу та їх значення. - Теоретичні основи аналітичної хімії
Кількісне визначення хімічним методом складається з трьох основних етапів: -відмірювання певної кількості речовини для аналізу; -проведення певної...
-
Дослідження взаємного розподілу значень економічних показників і знаходження співвідношень функціонування виробничих систем представляє наступний...
-
Якщо відома факторна модель узагальнюючого економічного показника, то наступним етапом аналізу являється виявлення величини абсолютної і відносної зміни...
-
Розрахуємо критерій Фішера [3]: (5.19) Де - обгрунтована складова дисперсії; - необгрунтована складова дисперсії; - загальна дисперсія; ,(5.20) Де -...
-
Оцінка на момент закінчення терміну дії опціону Припустимо, що нас цікавить вартість опціону "код" (далі просто "опціон") на момент закінчення його дії....
-
Методи окислення-відновлення, їх суть, класифікація - Теоретичні основи аналітичної хімії
Методи окислення-відновлення (редоксиметрії) грунтуються окисно-відновлювальних реакціях, які проходять між робочим розчином і визначуваною речовиною. До...
-
Титрометричний аналіз, його суть і методи - Теоретичні основи аналітичної хімії
Суть методу - Вимірювання об'єму розчину реактиву відомої концентрації, який витрачено на взаємодію з розчином визначуваної речовини, і за рівнянням...
-
Вхідними даними є бухгалтерська звітність, також може використовуватись і додаткова інформація переважно оперативного характеру, однак вона має лише...
-
Існує досить багато різноманітних методик оцінки фінансового планування підприємства. Найчастіше застосовуються методики на основі фінансових...
-
Застосовування гравіметричного аналізу в ТХК - Теоретичні основи аналітичної хімії
1) визначення заліза у вигляді оксиду - суть методу полягає в осадженні заліза у вигляді гідроксиду за допомогою гідроксиду амонію, висушуванні Fe(OH)3 і...
-
Методи визначення кальцію, Методи розділення - Питні мінеральні води
Для визначення кальцію часто доводиться попередньо видаляти всі елементи, крім лужних і лужноземельних. Методи розділення Електроліз із ртутним катодом....
-
Побудова інформаційної моделі - Моделі фінансового аналізу та їх застосування
Інформацімйна модемль - система сигналів, що свідчать про динаміку об'єкта управління, умови зовнішнього середовища та стан самої системи управління. В...
-
Ще однією можливістю підвищення зрізу фотоіонізації атома є збудження на останній стадії в автоіонізаційний стан. Автоіонізаційний стан (АС)- це стани...
-
Класифікація методів аналізу - Теоретичні основи аналітичної хімії
Хімічні й фізико хімічні методи аналізу. Загальна схема хімічних і фізико-хімічних методів аналізу зводиться до того, що досліджувану речовину переводять...
-
Перехід від одного опорного плану до іншого - Методи розв'язування різних типів економічних задач
Перехід від одного опорного плану до іншого здійснюють зміною базису, тобто через виключення з поточного базису якоїсь змінної та включення замість неї...
-
Методи визначення магнію, Методи розділення - Питні мінеральні води
Методи розділення Осадження магній - амоній фосфату. Осад MgNH4PO4 - 6H2O утворюється в амоніачному середовищі, у присутності солей амонію. Для того, щоб...
-
Капсули при звичайних методах фарбування залишаються безбарвними. Це дозволяє застосовувати прості методи фарбування для виявлення капсул мікроорганізмів...
-
ВСТУП, - Методи розв'язування різних типів економічних задач
Економіко-математичне моделювання є галуззю економічної науки, яка вивчає основні принципи та інструментарій постановки економічних задач, побудови їх...
-
Коли використовуються статичні та динамічні моделі - Моделі фінансового аналізу та їх застосування
У статистичних моделях приймаються допущення, I що економічні показники протягом визначеного періоду часу (звичайно рік) не міняються. У статичних...
-
При такому способі збуджений атом іонізується допоміжним лазерним випромінюванням або випромінюванням, що використовується в на одному з ступінів...
-
Об'єктом дослідження послужив сучасний осад мінералізований відібраний в літній час по глибині мулової колонки в інтервалі 50-100 см (мінералізація води...
-
Устаткування для мас-спектроскопії - Гібридні методи. Газова хромато-мас-спектрометрія
Мас-спектрометрію можна розглядати як сукупність двох окремих процесів: іонізації і поділу іонів по масах і реєстрації утворюються іони. Численні методи...
-
Апаратура та прилади Устаткування для хроматографії Всі хроматографи мають чотири основні частини: пристрій введення проби, хроматографічна колонка,...
-
Застосування ГХ-МС у вирішенні завдань безпеки - Гібридні методи. Газова хромато-мас-спектрометрія
Метод ГХ-МС широко використовують для аналізу більшості вибухових речовин до і після вибуху, оскільки інші методи (ЯМР, ІЧ-спектроскопія) не дозволяють...
-
ГХ-МС аналіз харчових продуктів - Гібридні методи. Газова хромато-мас-спектрометрія
ГХ-МС використовують для аналізу харчових ароматизаторів. Запропоновано різні методи видалення летких компонентів, пов'язаних з ароматизаторами, з їжі:...
-
Основні принципи застосування економіко-математичного аналізу до діяльності малих підприємств закладені в роботах [1,2,3]. Запропоновані методи...
-
Модуль ARIS ABS реалізує аналіз вартості процесів, при якому структура витрат повністю прозора, на відміну від методу встановлених нормативами...
-
В даний час існує ряд критеріїв для оцінки піно-утворення: 1. Властивості одинарної плівки. Ще Плато встановлено, що час життя плівки обернено...
Електроди першого роду - Електрохімічні методи аналізу, електродний потенціал