Електродний потенціал - Електрохімічні методи аналізу, електродний потенціал
Якщо занурити металеву пластинку у чисту воду, то йони, які містяться у вузлах кристалічної решітки металу, будуть гідратуватись полярними молекулами води, відокремлюватися від поверхні металу і переходити в розчин. На металевій пластинці залишається надлишок електронів, які надають її поверхні негативного заряду. Позитивно заряджені гідратовані йони, які перейшли у розчин під дією сил електростатичного притягання, залишаються безпосередньо біля поверхні металевої пластинки і утворюють так званий Подвійний електричний шар (рис. 1).
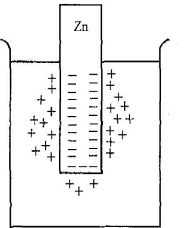
Рис.1. Схема виникнення подвійного електричного шару
Між металевою пластинкою і розчином виникає стрибок потенціалу, який називають Електродним потенціалом, А систему, що складається з металевої пластинки і розчину електроліту, - Електродом.
Одночасно з переходом йонів з металевої пластинки в розчин відбувається і зворотний процес - перехід дегідратованих йонів з розчину на металеву пластинку.
Якщо енергія кристалічної решітки металу більша, ніж енергія сольватації (гідратації) цих йонів у розчині, то метал заряджається позитивно, тобто йони переходять з розчину у метал. Якщо же енергія сольватації йонів більша, ніж енергія кристалічної решітки, то йони переходять у розчин и металічна пластинка заряджається негативно. Заряджена пластинка металу притягує до себе з розчину протилежно заряджені йони, які координуються поблизу поверхні електрода. В результаті на межі метал - розчин виникає подвійний електричний шар. На найближчій відстані від металевої пластинки, що дорівнює радіусу гідратованого йона, розміщена тільки частина йонів (адсорбційний шар), останні розподіляються в розчині дифузно (дифузний шар), тобто їх концентрація поступово зменшується при віддаленні від поверхні металу.
Рівноважний стан різниці потенціалів на межі поділу фаз метал - розчин називають Електродним потенціалом. Він обмежує процес подальшого переміщення йонів з металу або на метал, у зв'язку з чим кожному металу і певній концентрації його солі відповідає той чи інший потенціал. Величина електродного потенціалу залежить від природи металу та активності його йонів у розчині, її обчислюють за формулою:

Ц = ц0 + (MeN+)
Де ц0 - стандартний електродний потенціал;
R - універсальна газова стала;
Т - температура, за якої відбувається реакція;
N - кількість електронів, що втрачає а том металу;
F - стала Фарадея;
А (МеN+) - активність йонів металу в розчині.
Це рівняння називають Рівнянням Нернста. Якщо в нього підставити значення сталих величин (R = 8,314 Дж/моль-К; F = 9,65-104 Кл/моль), то для досить розбавлених розчинів за температури 298 К матимемо:

Ц = ц0 + (Меn+)
Гальванічний електродний потенціал водневий
Стандартний електродний потенціал - це електродний потенціал, який виникає при зануренні металевої пластинки в розчин, в якому активність йонів металу дорівнює 1 кмоль/м3.
Значення стандартних електродних потенціалів наведені в табл. 1.
Таким чином, величина електродного потенціалу залежить від температури, природи металу, активності йонів у розчині та природи розчинника. Із рівняння Нернста слідує, що при активності йонів, що дорівнює одиниці, величина електродного потенціалу дорівнює стандартному потенціалу. Величина стандартного потенціалу залежить тільки від природи електрода.
Стандартні електродні потенціали визначають за умовною шкалою, точкою відліку в якій є стандартний водневий електрод. Його потенціал умовно прийнятий рівним нулю.
Стандартний водневий електрод (рис. 3) - це платинова пластинка, занурена в розчин сульфатної кислоти з активністю йонів Н3О+ рівною, за температури 298 К, 1 моль/л. Платинову пластинку, покриту губчастою платиною, насичують воднем під тиском 101,3 кПа. Схематично стандартний водневий електрод записують так:
(Pt) Н2 | 2Н3О+
На його електроді відбувається реакція:
2Н3О+ + 2е? Н2 + 2Н2O.
Таблиця 1. Стандартні электродні потенциали при 298 К
|
Електрод |
Е0, В |
Електрод |
Е0, В |
|
Li+¦Li K+¦K Na+¦Na Mg2+¦Mg Al3+¦Al Zn2+¦Zn Fe2+¦Fe Cd2+¦Cd Pb, PbSO4¦SO42- Co2+¦Co Ni2+¦Ni Ag, Agl¦I- Sn2+¦Sn Pb2+¦Pb |
|
Pt(H2)¦H+ Ag, AgBr¦Br- Ag, AgCl¦KCl (нас.) Hg, Hg2Cl2¦KCl(нас.) Cu2+¦Cu Pt(O2)¦OH- Pt¦I2,I- Ag+¦Ag Hg22+¦Hg Pt¦Br2,Br Pt (Cl2)¦Cl- Au3+¦Au Au+¦Au |
|
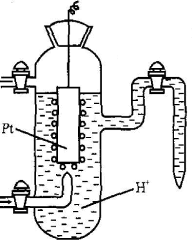
Рис.2. Стандартний водневий електрод
Рівняння Нернста для водневого електрода за стандартних умов має такий вигляд:
ЦВодн = ц0Водн + 0,059 lg (H3O+)
Враховуючи, що ц0водн дорівнює нулю (табл. 1), остаточно одержуємо:
ЦВодн = 0,059 lg (H3O+) = 0,059 рН
Похожие статьи
-
Електрохімічні методи засновані на використанні іонообмінних або електрообмінних процесах, що проходять на поверхні електроду або у приелектродному...
-
Основні методи кількісного аналізу та їх значення. - Теоретичні основи аналітичної хімії
Кількісне визначення хімічним методом складається з трьох основних етапів: -відмірювання певної кількості речовини для аналізу; -проведення певної...
-
Хроматографічні методи аналізу - Теоретичні основи аналітичної хімії
Хроматографічний метод - метод розділення та аналізу суміші речовин, заснований на відмінному розподілі їх між двома не змішуваними фазами - рухомій і...
-
Розрахуємо критерій Фішера [3]: (5.19) Де - обгрунтована складова дисперсії; - необгрунтована складова дисперсії; - загальна дисперсія; ,(5.20) Де -...
-
В залежності від якостей речовин, що використовуються для визначень, виділяють такі методи інструментального аналізу: 1) оптичні (визначення оптичних...
-
Основні методи гравіметричного аналізу - Теоретичні основи аналітичної хімії
Від чіткого розділення досліджуваної речовини залежить весь аналіз. Осад повинен бути чистим і без домішок. Звичайно, в процесі роботи осад захоплює з...
-
, I=1,2,3,...,n, Де P J ? 1 - ваговий коефіцієнт J -го вихідного показника. Розташовуючи значення показника ПJ В порядку зростання, можна визначити...
-
В даний час найбільшу увагу в питаннях дослідження забруднення навколишнього середовища приділяється аналізу природних і стічних вод. ГХ-МС з он-лайн...
-
Поняття про мас-спектроскопічний метод аналізу - Гібридні методи. Газова хромато-мас-спектрометрія
Мас-спектроскопія - метод дослідження речовини шляхом визначення мас іонів цієї речовини (частіше відношення мас іонів до їхніх зарядів) і їхніх...
-
Кореляційно-регресивний аналіз - це класичний метод стохастичного моделювання господарської діяльності. Він вивчає взаємозв'язки показників господарської...
-
Дослідження взаємного розподілу значень економічних показників і знаходження співвідношень функціонування виробничих систем представляє наступний...
-
Якщо відома факторна модель узагальнюючого економічного показника, то наступним етапом аналізу являється виявлення величини абсолютної і відносної зміни...
-
ВСТУП - Кількісні методи аналізу та їх використання для прийняття управлінських рішень
Кількісні, техніко-економічні економіко-математичні, методи особливо збагатили арсенал прийомів економічного аналізу господарської діяльності. Їх широке...
-
Кореляційний і регресивний методи аналізу зв'язку
Кореляційний і регресивний Методи аналізу зв'язку Основне завдання кореляційного і регресійного методів полягає в аналізі статистичних даних для...
-
Методи визначення кальцію, Методи розділення - Питні мінеральні води
Для визначення кальцію часто доводиться попередньо видаляти всі елементи, крім лужних і лужноземельних. Методи розділення Електроліз із ртутним катодом....
-
Класифікація методів аналізу - Теоретичні основи аналітичної хімії
Хімічні й фізико хімічні методи аналізу. Загальна схема хімічних і фізико-хімічних методів аналізу зводиться до того, що досліджувану речовину переводять...
-
Методи розв'язування стохастичних задач поділяють на дві групи -- прямі та непрямі. Прямі методи використовують для розв'язування задач стохастичного...
-
Поняття про хроматографію - Гібридні методи. Газова хромато-мас-спектрометрія
У 1952 р. англійський учений А. Дж. Мартін і його співробітник А. Джеймс, займаючись аналізом жирних кислот, зробили два дуже важливих спостереження....
-
Методи окислення-відновлення, їх суть, класифікація - Теоретичні основи аналітичної хімії
Методи окислення-відновлення (редоксиметрії) грунтуються окисно-відновлювальних реакціях, які проходять між робочим розчином і визначуваною речовиною. До...
-
В даний час існує ряд критеріїв для оцінки піно-утворення: 1. Властивості одинарної плівки. Ще Плато встановлено, що час життя плівки обернено...
-
Методи наближеного обчислення - Визначений інтеграл
Для деяких неперервних надінтегральних функцій F (х) первісну не можна виразити елементарними функціями. У цих випадках обчислення визначного інтеграла...
-
Методика аналізу товарних запасів на підприємстві - Структура витрат в управлінні запасами
C1 - витрати по зберіганню; C2 - витрати по доставці; R - обсяг попиту (товарообороту). Для визначення оптимальної частоти завозу (tопт) необхідні...
-
Титрометричний аналіз, його суть і методи - Теоретичні основи аналітичної хімії
Суть методу - Вимірювання об'єму розчину реактиву відомої концентрації, який витрачено на взаємодію з розчином визначуваної речовини, і за рівнянням...
-
Методи визначення магнію, Методи розділення - Питні мінеральні води
Методи розділення Осадження магній - амоній фосфату. Осад MgNH4PO4 - 6H2O утворюється в амоніачному середовищі, у присутності солей амонію. Для того, щоб...
-
Застосовування гравіметричного аналізу в ТХК - Теоретичні основи аналітичної хімії
1) визначення заліза у вигляді оксиду - суть методу полягає в осадженні заліза у вигляді гідроксиду за допомогою гідроксиду амонію, висушуванні Fe(OH)3 і...
-
Апаратура та прилади Устаткування для хроматографії Всі хроматографи мають чотири основні частини: пристрій введення проби, хроматографічна колонка,...
-
Мікропрепарат з культури клебсиєлл для виявлення у них капсули можна забарвити за методом Буррі - Гінса: 1. На чисте предметне скло наноситься невелика...
-
У системі управління реальними інвестиціями оцінка ефективності інвестиційних проектів є одним з найбільш відповідальних етапів. Від того, наскільки...
-
Складемо симплексну таблицю для першого опорного плану задачі. Елементи останнього рядка симплекс-таблиці є оцінками j, за допомогою яких опорний план...
-
Капсули при звичайних методах фарбування залишаються безбарвними. Це дозволяє застосовувати прості методи фарбування для виявлення капсул мікроорганізмів...
-
Побудова інформаційної моделі - Моделі фінансового аналізу та їх застосування
Інформацімйна модемль - система сигналів, що свідчать про динаміку об'єкта управління, умови зовнішнього середовища та стан самої системи управління. В...
-
Кореляційно-регресійний аналіз - це побудова та аналіз економіко-математичної моделі у вигляді рівняння регресії (рівняння кореляційного зв'язку), що...
-
Поняття машинного інформаційного забезпечення - Моделі фінансового аналізу та їх застосування
Важливою складовою інформаційного забезпечення є інформаційна база, що складається з машинної та позамашинної інформаційної бази. Машинна інформаційна...
-
1. Фіксовані мазки поміщають на 2 хв. в хлороформ. 2. Переносять в 5% водний розчин хромової кислоти на 2 - 10 хв. 3. Промивають в проточній воді і...
-
Розглядаючи моделі для аналізу фінансового стану можна зробити висновок, що вони дуже подібні між собою, але їхнім недоліком є те, що вони розраховують...
-
Вхідними даними є бухгалтерська звітність, також може використовуватись і додаткова інформація переважно оперативного характеру, однак вона має лише...
-
Розробка математичного забезпечення інформаційної системи Характеристика моделей і методів рішення економічної задачі Фінансовий аналіз здійснюється за...
-
Розвиток будь-якого підприємства потребує визначення його реального планування та ефективності його фінансово-господарської діяльності, у зв'язку з чим...
-
Існує досить багато різноманітних методик оцінки фінансового планування підприємства. Найчастіше застосовуються методики на основі фінансових...
-
Засновниками Товариства відповідно до діючого законодавства є особи, що прийняли рішення про його створення, затвердили умови та положення Установчих...
Електродний потенціал - Електрохімічні методи аналізу, електродний потенціал