Йонселективні електроди - Електрохімічні методи аналізу, електродний потенціал
Йонселективні електроди (ЙСЕ) - це електрохімічні датчики, потенціали яких залежать від активності певного виду йонів у розчині. Ці йони називають Потенціалоутворюючими, А електроди - Йонселективними ("селективний" означає "вибірковий'").
Нині промисловість випускає понад 30 видів йонселективних електродів, за допомогою яких можна визначити більше 50 катіонів, аніонів та молекулярних сполук. Найбільшого застосування знайшли електроди, селективні до йонів F?, Сl?, CN?, S2? NO3?, Pb2+, Na+, К+, Са2+, Mg2+, a також для визначення газів (СО2, NH3 НС1, H2S, HCN, NO) та молекул (ацетилхоліну, сечовини, глюкози та ін.).
Особливо великого значення набули йонселективні електроди у медицині та біології. За їх допомогою стало можливим спостерігати за зміною ионного складу біологічних рідин у динаміці, одержувати інформацію про зміну концентрації йонів Na+, Ca2+, С1? тощо як у внутрішньо-, так і в позаклітинному просторі.
Йонселективний електрод (рис. 5) складається з корпуса 1, найчастіше пластмасового, внутрішнього допоміжного електрода 2, зануреного у внутрішній розчин 5, і найсуттєвішої його частини - мембрани 4.
Тому такі електроди часто називають мембранними і класифікують за типом мембрани: скляні, кристалічні, рідкі та плівкові. Суттєвим є те, що всі мембрани містять електродноактивні речовини, які й забезпечують процес селективного обміну йонами між мембраною та розчином.
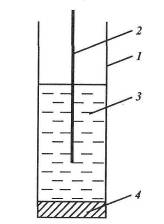
Рис. 5. Схема йонселективного електрода.
При зануренні йонселективного електрода у досліджуваний розчин електродна мембрана відокремлює цей розчин від зовнішнього розчину, Між мембраною та обома розчинами починається процес обміну йонами, які рухаються в напрямку фази з меншою активністю йонів цього виду. Оскільки мембрана не пропускає частину йонів, то по обидва її боки через певний проміжок часу виникає стрибок потенціалу, який перешкоджає подальшому переходу йонів між фазами. Таким чином досягається рівноважний розподіл йонів між розчинами та мембраною.
Основною характеристикою йонселективних електродів є їх селективність, тобто потенціал електрода реагує на зміну активності тільки одного виду йонів.
Йонселективні електроди класифікують за агрегатним станом елек-тродноактивного матеріалу.
Йонселектиені електроди зі скляною мембраною складаються (рис. 6) із скляної трубки (корпусу) 1, до якої припаяна куляста мембрана 3 із електродного сила: натрієвого (SiO2, Na2O, CaO) або літієвого (SiO2, Li2O, CaO). У корпусі електрода знаходиться розчин НС1 з певною концентрацією йонів H3O+ 4, в який занурений допоміжний електрод 2, найчастіше хлоросрібний.
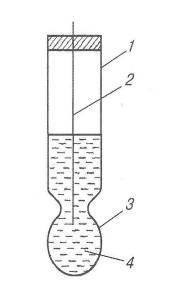
Рис. 6. Скляний електрод
Винятково висока селективність скляних електродів до Йонів гїдроксонію зумовлена хімічною природою скла. Потенціал скляного електрода залежить від активності йонів гідроксонію в розчині. Такі електроди називають Скляними електродами з водневою функцією і використовують для потенціометричного визначення рН розчинів.
Скляний електрод з водневою функцією перед застосуванням вимочують протягом доби у дистильованій воді або слабкому розчині хлоридиої кислоти.
Стандартний потенціал скляних електродів залежить від виду електродного скла і змінюється з часом, тому перед застосуванням їх калібрують за стандартними розчинами відповідних електролітів.
Електрохімічним (гальванічним) елементом Називають пристрій, у якому хімічна енергія окисно-відновного процесу перетворюється є електричну. При цьому процеси окяснення та відновлення просторово розділені. Найпростіший електрохімічний елемент складається з двох напівелементів (електродів), сполучених між собою. Наприклад, елемент Якобі - Даніеля, схема якого зображена на рис. 7, складається з цинкового електрода (цинкової пластинки у розчині ZnSO4), який схематично записують Zn | ZnSO4, і мідного електрода (мідної пластинки у розчині CuSO4) - Cu | CuSO4.
Діафрагма D, Що розділяє обидва розчини, пропускає йони, але не дає можливості змішуватися електродним рідинам. Якщо електричне коло розімкнене, то у подвійному шарі на електродах швидко настає рівновага. Цинкова пластинка елемента Якобі - Даніеля порівняно легко віддає свої катіони у розчин, тому що згідно з положенням у ряді стандартних електродних потенціалів цинк має здатність до окиснення: ц = - 0,74 В. Кожний йон Цинку, переходячи у розчин, залишає на пластинці два електрони, внаслідок чого вона набуває негативного заряду. На мідному електроді відбувається процес відновлення йонів Купруму, внаслідок чого електрод заряджається позитивно, а прилеглий шар розчину - негативно.
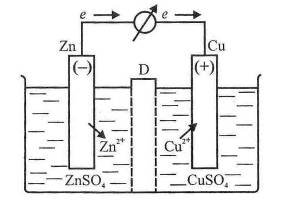
Рис. 7. Схема елемента Якобі-Даніеля
Якщо замкнути коло, тобто сполучити мідний та цинковий електроди дротом (рис. 7), У ньому виникне електричний струм. Електрони з місця, де густина негативного заряду вища (з цинкової пластинки), будуть переміщуватися до місця з меншою густиною негативного заряду або до місця з позитивним зарядом (тобто До Мідної пластинки). При цьому на цинковому електроді відбуватиметься процес окиснення:
ZnZn2++2e?,
А на мідному - процес відновлення:
Cu2+ + 2e? Cu
Загальну хімічну реакцію, яка відбувається у мідно-цинковому еле
Менті, можна записати в йонній формі:
Zn + Cu2+ Zn2+ + Cu
Або в молекулярній формі:
Zn + CuSO4 Си + ZnSO4
Де Q = 230 КДж - Величина хімічної енергії, яка перетворюється в електричну.
Усі електрохімічні елементи записують за правилом "правого плюса", тобто зліва знаходиться негативний електрод, справа - позитивний, іноді полярність електрода додатково записують у дужках. Електроди позначають символами хімічних елементів, межу поділу між електродом і розчином - вертикальною рискою, межу поділу між двома розчинами - двома вертикальними рисками, або, якщо дифузійний потенціал не усунутий, штрихом. Наприклад, елемент Якобі - Даніеля записують так:
Cu| (?)Zn | ZnSO4 || CuSO4 | Cu(+) |Cu
Ц(?) цД =0 ц(+)
Де ц(?) і ц(+) - електродні потенціали;
ЦД - дифузійний потенціал.
Важливою кількісною характеристикою електрохімічного елемента є Електрорушійна сила (ЕРС, або Е), Яка дорівнює різниці електродних потенціалів:
Е = ц(+) - ц(?)
Електрорушійна сила гальванічного елемента - величина завжди позитивна, оскільки вона відповідає процесу, що відбувається самочинно, і характеризує позитивну роботу.
У гальванічних колах, які складаються з двох напівелементів, що відрізняються складом розчинів (як в елементі Якобі - Даніеля) або концентрацією (концентраційні кола), крім потенціалів на межі електрод - розчин виникає додатковий потенціал на межі розчин - розчин. Цей потенціал називають дифузійним. Причиною його виникнення є різна швидкість руху катіонів та аніонів солі. Розглянемо причини виникнення дифузійного потенціалу на межі двох розчинів аргентум нітрату різної концентрації у срібному концентраційному елементі.
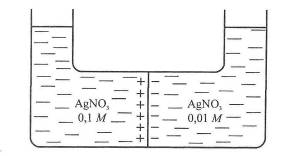
Рис. 8. Схема виникнення дифузійного потенціалу
На рис. 8 зображені два контактуючі розчини AgNO3 різної активності. Внаслідок дифузії позитивні і негативні йони переміщуються від розчину з більшою активністю до розчину з меншою активністю. Нітрат-іони NO3? характеризуються більшою швидкістю переміщення, ніж йони Аргентуму Ag+. Внаслідок цього в розчині з меншою активністю солі виникає надлишок аніонів, а в розчині з більшою - надлишок катіонів. Отже, у цьому випадку розчин з меншою концентрацією солі набуває негативного заряду, а з більшою - позитивного, і виникає різниця потенціалів, яку називають Дифузійним потенціалом.
Виникнення дифузійного потенціалу призводить до гальмування руху швидких та прискорення руху повільніших йонів.
Дифузійний потенціал виникає не тільки на межі поділу розчинів різної концентрації, а й у таких гальванічних колах, де контактують розчини з однаковою активністю йонів, але з різними за швидкістю руху катіонами чи аніонами.
Близьким за своєю природою до дифузійного є Мембранний потенціал. Якщо між двома розчинами є мембрана, яка вибірково пропускає катіони і затримує аніони, то по обидві її сторони накопичуються йони протилежного знака і одна з них заряджається позитивно, а інша - негативно, тобто виникає мембранний потенціал цМ.
Дифузія катіонів крізь мембрану не є нескінченною, оскільки їх притягують аніони, що залишилися по інший бік мембрани. На мембрані встановлюється рівновага між швидкістю дифузії та її електричним полем, потенціал якого визначають за рівнянням Нернста для ЕРС концентраційного кола:
ЦМ =

Де і - активності катіонів по різні боки мембрани, причому > .
Мембранні та дифузійні потенціали виникають у клітинах рослинних та тваринних організмів і призводять до утворення різних біопотенціалів та біострумів. Мембранний потенціал може існувати без змін тривалий час.
Як відомо, нервова клітина людини складається з тіла клітини та одного довгого відростка діаметром 10?5?10?7 м, який називають аксоном. Клітина та аксон, що відходить від неї, оточені мембраною, тому концентрація йонів усередині клітини відрізняється від концентрації тих самих йонів у зовнішньому середовищі. Йонний склад нервової клітини та середовища наведений у табл. 3.
Табл. 3. Йонний склад нервової клітини.
|
Йони |
Концентрація, ммоль/дм3 | |
|
У клітині |
У зовнішньому середовищі | |
|
К+ Na+ Cl? Органічні йони |
|
|
Різна концентрація йонів по обидві сторони Мембрани Нервової клітини призводить до встановлення мембранного потенціалу. Мембрани нервових клітин, що перебувають у спокої, приблизно у 100 разів більш проникні для йонів К+, ніж для йонів Na+.
Це означає, що між внутрішньою та зовнішньою сторонами клітинної мембрани виникає різниця потенціалів, що дорівнює 75 мВ. Цю величину, виміряну у стані фізіологічного спокою клітини, називають Потенціалом спокою. Потенціал спокою у різних клітин становить 50-100 мВ. Встановлено, що цитоплазма клітини в стані спокою завжди має від'ємний потенціал відносно потенціалу міжклітинної рідини.
Якщо нервову тканину збуджувати електрично, хімічно чи механічно, то мембрана клітини стає більш проникною для йонів Na+, ніж для йонів К+ . Йони Na+ починають проникати всередину клітини, що призводить до зміни мембранного потенціалу цМ.
Таким чином, упродовж короткого проміжку часу (приблизно 10?4 с) мембранний потенціал змінюється від -75 до +50 мВ. Таке раптове підвищення та падіння мембранного потенціалу називають Потенціалом дії.
Залежно від довжини аксона та інших чинників швидкість, з якою відбувається передача потенціалу дії, становить 30-150 м/с. Як тільки потенціал дії віддаляється від точки збудження клітини, мембрана знову стає готовою до збудження. Це можливе тому, що за один потенціал дії аксон поглинає 3-10 ?11 ? 4-10?11 моль йонів Na+ На 1 см2 поверхні волокна і віддає таку ж саму кількість йонів К+, що не вносить суттєвих змін в йонне середовище аксона. Тому натрїй-калієвий механізм здатний генерувати кілька сотень тисяч потенціалів дії.
Потенціали дії створюють струм (біопотенціали та біоструми), тому два електроди, прикладені до різних ділянок тіла, реєструють різницю потенціалів. Це покладено в основу електрокардіографічних, електроенцефалографічних, електроміографічних методів діагностики.
Похожие статьи
-
Електроди першого роду - Електрохімічні методи аналізу, електродний потенціал
Електроди цього типу складаються з металевої пластинки, зануреної в розчин однойменних катіонів. Вони оборотні відносно катіона або аніона і є...
-
Електродний потенціал - Електрохімічні методи аналізу, електродний потенціал
Якщо занурити металеву пластинку у чисту воду, то йони, які містяться у вузлах кристалічної решітки металу, будуть гідратуватись полярними молекулами...
-
Окисно-відновні електроди. - Електрохімічні методи аналізу, електродний потенціал
Окисно-відновними називають такі електроди, метал яких не бере участі в окисно-відновній реакції, а є тільки переносником електронів, процес же окиснення...
-
Електрохімічні методи засновані на використанні іонообмінних або електрообмінних процесах, що проходять на поверхні електроду або у приелектродному...
-
Поняття про мас-спектроскопічний метод аналізу - Гібридні методи. Газова хромато-мас-спектрометрія
Мас-спектроскопія - метод дослідження речовини шляхом визначення мас іонів цієї речовини (частіше відношення мас іонів до їхніх зарядів) і їхніх...
-
Основні методи кількісного аналізу та їх значення. - Теоретичні основи аналітичної хімії
Кількісне визначення хімічним методом складається з трьох основних етапів: -відмірювання певної кількості речовини для аналізу; -проведення певної...
-
В залежності від якостей речовин, що використовуються для визначень, виділяють такі методи інструментального аналізу: 1) оптичні (визначення оптичних...
-
В даний час найбільшу увагу в питаннях дослідження забруднення навколишнього середовища приділяється аналізу природних і стічних вод. ГХ-МС з он-лайн...
-
, I=1,2,3,...,n, Де P J ? 1 - ваговий коефіцієнт J -го вихідного показника. Розташовуючи значення показника ПJ В порядку зростання, можна визначити...
-
Дослідження взаємного розподілу значень економічних показників і знаходження співвідношень функціонування виробничих систем представляє наступний...
-
Якщо відома факторна модель узагальнюючого економічного показника, то наступним етапом аналізу являється виявлення величини абсолютної і відносної зміни...
-
ВСТУП - Кількісні методи аналізу та їх використання для прийняття управлінських рішень
Кількісні, техніко-економічні економіко-математичні, методи особливо збагатили арсенал прийомів економічного аналізу господарської діяльності. Їх широке...
-
Основні методи гравіметричного аналізу - Теоретичні основи аналітичної хімії
Від чіткого розділення досліджуваної речовини залежить весь аналіз. Осад повинен бути чистим і без домішок. Звичайно, в процесі роботи осад захоплює з...
-
Кореляційний і регресивний методи аналізу зв'язку
Кореляційний і регресивний Методи аналізу зв'язку Основне завдання кореляційного і регресійного методів полягає в аналізі статистичних даних для...
-
Кореляційно-регресивний аналіз - це класичний метод стохастичного моделювання господарської діяльності. Він вивчає взаємозв'язки показників господарської...
-
Хроматографічні методи аналізу - Теоретичні основи аналітичної хімії
Хроматографічний метод - метод розділення та аналізу суміші речовин, заснований на відмінному розподілі їх між двома не змішуваними фазами - рухомій і...
-
Розрахуємо критерій Фішера [3]: (5.19) Де - обгрунтована складова дисперсії; - необгрунтована складова дисперсії; - загальна дисперсія; ,(5.20) Де -...
-
Дана група методів є однією з найбільш поширених в системі прогнозування економічних явищ, зокрема і перспективного попиту на продукцію вугільної...
-
Технічне забезпечення являє собою комплекс технічних засобів, що застосовуються для функціонування інформаційної системи, і містять у собі пристрої, за...
-
В даний час існує ряд критеріїв для оцінки піно-утворення: 1. Властивості одинарної плівки. Ще Плато встановлено, що час життя плівки обернено...
-
При організації раціонального варіанта внутрішньо-машинної інформаційної бази даних, яка найбільш повно відбиває специфіку об'єкта управління, перед...
-
Закритою називається транспортна задача в якій загальна кількість продукції постачальників дорівнює загальному попиту всіх споживачів, тобто . Теорема:...
-
Методи визначення магнію, Методи розділення - Питні мінеральні води
Методи розділення Осадження магній - амоній фосфату. Осад MgNH4PO4 - 6H2O утворюється в амоніачному середовищі, у присутності солей амонію. Для того, щоб...
-
Методи визначення кальцію, Методи розділення - Питні мінеральні води
Для визначення кальцію часто доводиться попередньо видаляти всі елементи, крім лужних і лужноземельних. Методи розділення Електроліз із ртутним катодом....
-
Об'єктом дослідження послужив сучасний осад мінералізований відібраний в літній час по глибині мулової колонки в інтервалі 50-100 см (мінералізація води...
-
Апаратура та прилади Устаткування для хроматографії Всі хроматографи мають чотири основні частини: пристрій введення проби, хроматографічна колонка,...
-
Класифікація методів аналізу - Теоретичні основи аналітичної хімії
Хімічні й фізико хімічні методи аналізу. Загальна схема хімічних і фізико-хімічних методів аналізу зводиться до того, що досліджувану речовину переводять...
-
До складу фракцій нафти і нафтопродуктів можуть входити тисячі компонентів. До найпростіших фракцій - природний газ, який складається в основному з...
-
Спори та їх характеристика - Методи фарбування бактеріальних спор і капсул
Багато видів бактерій володіють здатністю спорооутворення, яка полягає в тому, що при настанні умов, несприятливих для життя, клітина змінює свою...
-
Даний метод дає можливість прогнозувати попит на основі статистичної моделі, яка характеризує залежність між об'єктом (обсягом збуту) та незалежними...
-
Капсули при звичайних методах фарбування залишаються безбарвними. Це дозволяє застосовувати прості методи фарбування для виявлення капсул мікроорганізмів...
-
Розглянемо вихідні дані 1 (табл.(1)) і рекомендовані нам залежності, проведемо регресійний аналіз для всіх рекомендованих залежностей та виявимо яка з...
-
Ще однією можливістю підвищення зрізу фотоіонізації атома є збудження на останній стадії в автоіонізаційний стан. Автоіонізаційний стан (АС)- це стани...
-
Дана стаття присвячена розробці експрес-методу ідентифікаціі каротиноїдів в лікарській рослинній сировині з допомогою мас-спектроскопії в поєднанні з...
-
При такому способі збуджений атом іонізується допоміжним лазерним випромінюванням або випромінюванням, що використовується в на одному з ступінів...
-
Оцінка на момент закінчення терміну дії опціону Припустимо, що нас цікавить вартість опціону "код" (далі просто "опціон") на момент закінчення його дії....
-
ГХ-МС аналіз харчових продуктів - Гібридні методи. Газова хромато-мас-спектрометрія
ГХ-МС використовують для аналізу харчових ароматизаторів. Запропоновано різні методи видалення летких компонентів, пов'язаних з ароматизаторами, з їжі:...
-
Методи окислення-відновлення, їх суть, класифікація - Теоретичні основи аналітичної хімії
Методи окислення-відновлення (редоксиметрії) грунтуються окисно-відновлювальних реакціях, які проходять між робочим розчином і визначуваною речовиною. До...
-
З - АСУ підприємства підсистема фінансового аналізу ТОВ "Цегельний завод ім. М. Г. Миндру"
Графік робіт зі створення інформаційної системи Учасники створення інформаційної системи Учасник Відділ Ставка Обсяг робіт Сума Середній керівний склад...
-
Модуль ARIS ABS реалізує аналіз вартості процесів, при якому структура витрат повністю прозора, на відміну від методу встановлених нормативами...
Йонселективні електроди - Електрохімічні методи аналізу, електродний потенціал