Потенціометричні методи дослідження в медицині - Електрохімічні методи аналізу, електродний потенціал
Метод Визначення рН, який грунтується на вимірюванні електрорушійної сили певних гальванічних елементів, називають потенціометричним. Він, порівняно з індикаторним, має ряд переваг, а саме ~ високу точність, можливість вимірювання рН багатокомпонентних систем, забарвлених та каламутних розчинів. Із розвитком електродної техніки його все ширше використовують у біології, медицині та фармації. Оскільки даний метод є неруйнівним, то його застосовують для вимірювання рН різних біологічних середовищ та органів. Не менш важливе значення має метод рН-метрії для дослідження біохімічних, ферментних та фізіологічних процесів In vitro.
Контроль рН, а також можливий на основі рН-метричної техніки контроль вмісту газів у крові - необхідні елементи наукового дослідження та лікування деяких захворювань. Потенціометричне вимірювання рН застосовують також для безперервного контролю кислотності під час хірургічних втручань, при діагностиці деяких шкірних захворювань, дослідженні нових лікарських препаратів тощо. У наш час розроблені електродні системи, які застосовують для контролю кислотності безпосередньо у травній системі людини. Для цього у шлунок хворого вводять капсулу, що містить скляний та хлоросрібний мікроелектроди або їх комбінацію. Скляні електроди різної конструкції дають можливість вимірювати рН біологічних рідин, тканин та окремих клітин.
Важливим є визначення рН середовища у процесі виробництва лікарських препаратів.
Для визначення рН потрібно скласти гальванічний елемент з двох електродів: перший - стандартний (електрод порівняння) зі сталим значенням електродного потенціалу; другий - електрод визначення (індикаторний), потенціал якого залежить від концентрації (активності) йонів Гідрогену. При потенціометричному визначенні рН найчастіше застосовується як електрод порівняння хлорсрібний, а як індикаторний - скляний електрод з водневою функцією.
Для вимірювання рН складають гальванічне коло зі скляного електрода з водневою функцією (індикаторного) і хлор срібного (електрода порівняння). ЕРС такого елемента вимірюють спеціальними приладами - потенціометрами, які дістали назву рН-метрів.
Методика визначення рН розчинів чи біологічних рідин така:
- 1) Підготувати рН-метр до роботи за інструкцією з експлуатації приладу і відкалібрувати скляний електрод за серією стандартних буферних розчинів. 2) Перед зануренням електродів (скляного і хлорсрібного) у досліджуваний розчин їх потрібно промити дистильованою водою і висушити фільтрувальним папером. 3) Вибрати на приладі відповідний режим роботи і виміряти величину рН. 4) Після закінчення вимірювань електроди зберігати зануреними в дистильовану воді або в 0,1 М розчин НСl.
Потенціометричним титруванням називають метод визначення концентрації або кількості речовини за даними потенціометричних вимірів. На їх підставі будують криві титрування, за якими визначають точку еквівалентності, поблизу якої відбувається різка зміна (стрибок) потенціалу індикаторного електрода.
Потенціометричне титрування застосовують для визначення концентрацій розчинів електролітів. Класифікація потенціометричних методів аналізу така сама, що і звичайних об'ємних методів титрування. В її основу покладені різні типи хімічних реакцій: нейтралізації, осадження, комплексоутворення, окиснення-відновлення тощо.
Для потенціометричного титрування складають коло з індикаторного електрода, який занурюють у досліджуваний розчин, та електрода порівняння.
Індикаторний електрод - це електрод, який реагує на зміну в розчині активності визначуваного йона або йонів титранту. Величину його потенціалу визначають відносно будь-якого електрода, який не поляризується і потенціал якого не змінюється під час титрування. Такий електрод, що служить тільки для визначення потенціалу індикаторного електрода, називають електродом порівняння або стандартним електродом. Ними можуть бути електроди другого роду за умови збереження постійної концентрації йонів, що характеризують електродний процес. Найширшого застосування набували такі електроди порівняння: хлоросрібний, каломельний.
Використовуючи два електроди, складають гальванічний елемент, електрорушійна сила якого контролюється в процесі титрування. її зміну зображають графічно (рис. 9), де на осі ординат відкладають ЕРС, а на осі абсцис - об'єм доданого титранту.
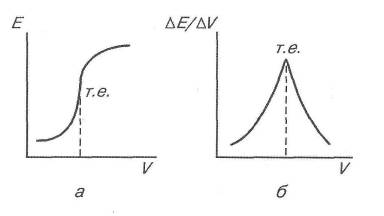
Рис. 9. Криві потенціометричного титрування сульфатної кислоти лугом:
А - інтегральна; б - диференціальна.
Графік (рис.6 а) називають інтегральною кривою потенціометричного титрування. З цього графіка видно, що на початку титрування швидкість зміни електрорушійної сили мала, далі вона зростає, а потім знову практично не збільшується. Різка зміна електрорушійної сили, або стрибок ЕРС, що виникає внаслідок зміни потенціалу індикаторного електрода, відповідає точці еквівалентності (середина стрибка).
Якщо у розчині присутні кілька йолів, що можуть вступати у взаємодію з титрантом, то за певних умов може відбуватися їх ступінчасте осадження або нейтралізація.
На кривих титрування (рис. 10) у цьому випадку буде спостерігатися кілька стрибків ЕРС (або максимумів на диференційній кривій), кожен з яких відповідатиме нейтралізації або осадженню певного йона. Першим титрується сильніший електроліт (кислота чи основа) або йон, що утворює з йоном титранту сіль з меншим значенням добутку розчинності.
Для проведення потенціометричного аналізу сумішей кислот, основ або солей необхідно, щоб ці електроліти сильно відрізнялись за силою, бо інакше титрування суміші відбуватиметься як титрування одного компонента.
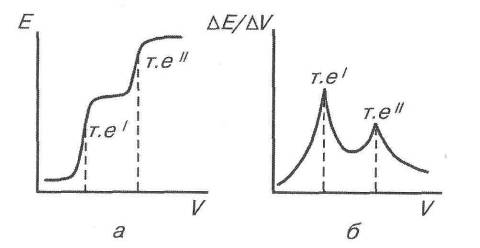
Рис.10. Криві титрування суміші сульфатної і ацетатної кислот
А - інтегральна крива; б - диференціальна крива
Отже, вивчення механізму виникнення електродного, дифузійного, мембранного та окисно-відновного потенціалів та їх залежності від різних чинників дає змогу зрозуміти закономірності перебігу більшості біохімічних реакцій. Вимірювання біопотенціалів покладене в основу таких важливих діагностичних методів, як електрокардіографія, електроенцефалографія тощо, а за величиною ЕРС визначають вміст фізіологічно-активних йонів (Н3О+, К+, Na+, Са2+, СІ?, NO3? тощо) у біологічних рідинах та тканинах організму.
Електрохімічні методи аналізу знайшли широке застосування у медико-біологічних дослідженнях.
Похожие статьи
-
Йонселективні електроди - Електрохімічні методи аналізу, електродний потенціал
Йонселективні електроди (ЙСЕ) - це електрохімічні датчики, потенціали яких залежать від активності певного виду йонів у розчині. Ці йони називають...
-
Електроди першого роду - Електрохімічні методи аналізу, електродний потенціал
Електроди цього типу складаються з металевої пластинки, зануреної в розчин однойменних катіонів. Вони оборотні відносно катіона або аніона і є...
-
Окисно-відновні електроди. - Електрохімічні методи аналізу, електродний потенціал
Окисно-відновними називають такі електроди, метал яких не бере участі в окисно-відновній реакції, а є тільки переносником електронів, процес же окиснення...
-
Електродний потенціал - Електрохімічні методи аналізу, електродний потенціал
Якщо занурити металеву пластинку у чисту воду, то йони, які містяться у вузлах кристалічної решітки металу, будуть гідратуватись полярними молекулами...
-
Електрохімічні методи засновані на використанні іонообмінних або електрообмінних процесах, що проходять на поверхні електроду або у приелектродному...
-
Основні методи кількісного аналізу та їх значення. - Теоретичні основи аналітичної хімії
Кількісне визначення хімічним методом складається з трьох основних етапів: -відмірювання певної кількості речовини для аналізу; -проведення певної...
-
Поняття про мас-спектроскопічний метод аналізу - Гібридні методи. Газова хромато-мас-спектрометрія
Мас-спектроскопія - метод дослідження речовини шляхом визначення мас іонів цієї речовини (частіше відношення мас іонів до їхніх зарядів) і їхніх...
-
В залежності від якостей речовин, що використовуються для визначень, виділяють такі методи інструментального аналізу: 1) оптичні (визначення оптичних...
-
Дослідження взаємного розподілу значень економічних показників і знаходження співвідношень функціонування виробничих систем представляє наступний...
-
В даний час найбільшу увагу в питаннях дослідження забруднення навколишнього середовища приділяється аналізу природних і стічних вод. ГХ-МС з он-лайн...
-
Хроматографічні методи аналізу - Теоретичні основи аналітичної хімії
Хроматографічний метод - метод розділення та аналізу суміші речовин, заснований на відмінному розподілі їх між двома не змішуваними фазами - рухомій і...
-
Основні методи гравіметричного аналізу - Теоретичні основи аналітичної хімії
Від чіткого розділення досліджуваної речовини залежить весь аналіз. Осад повинен бути чистим і без домішок. Звичайно, в процесі роботи осад захоплює з...
-
Якщо відома факторна модель узагальнюючого економічного показника, то наступним етапом аналізу являється виявлення величини абсолютної і відносної зміни...
-
, I=1,2,3,...,n, Де P J ? 1 - ваговий коефіцієнт J -го вихідного показника. Розташовуючи значення показника ПJ В порядку зростання, можна визначити...
-
В даний час існує ряд критеріїв для оцінки піно-утворення: 1. Властивості одинарної плівки. Ще Плато встановлено, що час життя плівки обернено...
-
ВСТУП - Кількісні методи аналізу та їх використання для прийняття управлінських рішень
Кількісні, техніко-економічні економіко-математичні, методи особливо збагатили арсенал прийомів економічного аналізу господарської діяльності. Їх широке...
-
Кореляційний і регресивний методи аналізу зв'язку
Кореляційний і регресивний Методи аналізу зв'язку Основне завдання кореляційного і регресійного методів полягає в аналізі статистичних даних для...
-
Газова хромато-мас-спектрометрія - Гібридні методи. Газова хромато-мас-спектрометрія
Вже давно мас-спектрометр розглядають як відмінний детектор для газової хроматографії. Як газовий хроматограф, так і мас-спектрометр являють собою в...
-
Методи визначення кальцію, Методи розділення - Питні мінеральні води
Для визначення кальцію часто доводиться попередньо видаляти всі елементи, крім лужних і лужноземельних. Методи розділення Електроліз із ртутним катодом....
-
Літературний огляд, Гібридні методи - Гібридні методи. Газова хромато-мас-спектрометрія
Гібридні методи Гібридні методи аналізу -- група методів, що базуються на поєднанні різноманітних способів розділення багатокомпонентних сумішей,...
-
ГХ-МС аналіз харчових продуктів - Гібридні методи. Газова хромато-мас-спектрометрія
ГХ-МС використовують для аналізу харчових ароматизаторів. Запропоновано різні методи видалення летких компонентів, пов'язаних з ароматизаторами, з їжі:...
-
Дана група методів є однією з найбільш поширених в системі прогнозування економічних явищ, зокрема і перспективного попиту на продукцію вугільної...
-
Класифікація методів аналізу - Теоретичні основи аналітичної хімії
Хімічні й фізико хімічні методи аналізу. Загальна схема хімічних і фізико-хімічних методів аналізу зводиться до того, що досліджувану речовину переводять...
-
Кореляційно-регресивний аналіз - це класичний метод стохастичного моделювання господарської діяльності. Він вивчає взаємозв'язки показників господарської...
-
Загальна характеристика ТОВ "Цегельний завод ім. М. Г Миндру" Загальні положення Товариство з обмеженою відповідальністю "Цегельний завод ім. М. Г...
-
Структура дослідження інтеракційного та трансакційного полів розподілу доходів в моделі одиничної економіки агрегованого ринку Інституційний аспект...
-
Кристали сульфіду цинку, активовані іонами Мn2+, досліджуються вже досить давно. Будь-яке дослідження спектрів ФЛ кристалів, буде далеко не повним без...
-
Даний метод дає можливість прогнозувати попит на основі статистичної моделі, яка характеризує залежність між об'єктом (обсягом збуту) та незалежними...
-
В основі методології фінансово-економічного аналізу лежить діалектичний метод, тобто економічні явища, що вивчаються, аналізуються, розглядаються у...
-
У роботі розглядаються безперервні функції F З періодом 2p і їх наближення тригонометричними поліномами. Через Tn(x) Позначається тригонометричний...
-
BONAQUA МОРШИНСЬКА ЗНАМЕНІВСЬКА МИРГОРОДСЬКА Статистична обробка результатів аналізу Перевірка отриманих результатів вимірювання загальної лужності...
-
Перевірка отриманих результатів вимірювання на наявність грубих похибок за Q - критерієм при ? = 0,95 Де: Хі - отримані результати аналізу Перевірка...
-
Перехід від одного опорного плану до іншого - Методи розв'язування різних типів економічних задач
Перехід від одного опорного плану до іншого здійснюють зміною базису, тобто через виключення з поточного базису якоїсь змінної та включення замість неї...
-
Ще однією можливістю підвищення зрізу фотоіонізації атома є збудження на останній стадії в автоіонізаційний стан. Автоіонізаційний стан (АС)- це стани...
-
Методи окислення-відновлення, їх суть, класифікація - Теоретичні основи аналітичної хімії
Методи окислення-відновлення (редоксиметрії) грунтуються окисно-відновлювальних реакціях, які проходять між робочим розчином і визначуваною речовиною. До...
-
Теоретичні основи оптимізаційних рішень Умови оптимальності у формі принципу максимуму дають, узагалі говорячи, достатню інформацію для рішення задачі...
-
Грошовий потік Витрати в перший рік служби системи розраховуються як сума капітальних і експлуатаційних витрат. Грошовий потік розраховується як різниця...
-
Вхідними даними є бухгалтерська звітність, також може використовуватись і додаткова інформація переважно оперативного характеру, однак вона має лише...
-
Розробка математичного забезпечення інформаційної системи Характеристика моделей і методів рішення економічної задачі Фінансовий аналіз здійснюється за...
-
Розробка нових аналітичних методів визначення ультранизьких вмістів елементів в різних речовинах є на сьогодні актуальною для багатьох галузей сучасної...
Потенціометричні методи дослідження в медицині - Електрохімічні методи аналізу, електродний потенціал