Окислительное декарбоксилирование карбоновых кислот, Окисление бензола закисью азота - Особенность синтеза фенолов
Процесс окислительного декарбоксилирования состоит из двух основных стадий: окисления углеводорода до арилкарбоновой кислоты и собственно окислительного декарбоксилирования последней. С процессом связаны стадии разделения продуктов окислительного декарбоксилирования и возвращения в цикл водных растворов. Окислительное декарбоксилирование арилкарбоновых кислот проводится при 200--300°С в присутствии солей двухвалентной меди при подаче в реактор воздуха и водяного пара [17]:

Относительно механизма образования фенолов при окислении арилкарбоновых кислот существуют противоречивые точки зрения. Кэдинг и Толанд предполагают образование промежуточного соединения, образующегося при нуклеофильной атаке кольца атомом кислорода. При этом в реакции участвует димер медной соли, т. е. два атома меди находятся рядом. Некоторые авторы полагают, что процесс может проходит и по радикальному механизму. Однако большинство относят механизм окислительного декарбоксилирования к ионному типу [17].
Окисление бензола закисью азота
Прямое окисление бензола молекулярным кислородом представляется наиболее привлекательным методом получения фенола. Термодинамически N2O - неустойчивая эндотермическая. Однако кинетически закись азота весьма стабильна, ее некаталитическое разложение становится заметным лишь при температуре выше 600 0С.
В 1983 году впервые использовалась закись азота для окисления бензола в фенол. Эта реакция позволила выйти на принципиально новый уровень селективности по фенолу. При температуре 550 0С и добавлении в реакционную смесь 30% H2O селективность по фенолу на нанесенных ванадиевых катализаторах достигала 71% при конверсии бензола 10%. Однако селективность ванадиевых катализаторов оказалась не достаточно высокой для практического применения. Позже было установлено, что лучшими катализаторами этой реакции являются цеолиты ZSM-5. На цеолитах реакция протекает при значительно более низкой температуре и, что особенно важно, с селективностью по фенолу, близкой к 100. Исследования позволили установить, что разложение N2O протекает на центрах цеолита с образованием новой формы поверхностного кислорода, условно названной радикал - кислородом. В низкотемпературной области реакция образования радикал - кислорода носит стехиометрический характер: N2O + () = (O) + N2 [14]:
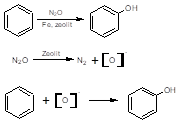
Активность цеолита появлялась только с введением железа, увеличиваясь по мере роста его концентрации. Это связано с тем, что железо в цеолите образует особые активные центры, которые и обеспечивают протекание каталитической реакции.
Похожие статьи
-
Получение фенола из кумола, Получение фенола из бензола и циклогексана - Особенность синтеза фенолов
Синтез на основе кумола имеет промышленное значение и ценен тем, что позволяет получать одновременно два технически важных продукта. Кумол при окислении...
-
Получение фенолов окислительным декарбоксилированием арилкарбоновых кислот - Синтез фенола
Одним из способов синтеза фенолов из углеводородов является двухстадийное окисление. На первой стадии тем или иным способом, чаще жидкофазным окислением...
-
Получение фенола окислением бензойной кислоты в газовой фазе - Синтез фенола
Фенол в промышленности также получают окислением бензойной кислоты в газовой фазе при 200-400°С в присутствии твердых катализаторов, например: солей меди...
-
Представление о механизме окислительного декарбоксилирования арилкарбоновых кислот - Синтез фенола
Окислительное декарбоксилирование арилкарбоновых кислот проводится при 200--300°С в присутствии солей двухвалентной меди при подаче в реактор воздуха и...
-
Полимеризация двуокиси азота. Переработка нитрозных газов в азотную кислоту обычно происходит при температурах от О до 50 °С. В этих условиях двуокись...
-
Получение фенола прямым каталитическим гидроксилированием бензола - Синтез фенола
Предложен способ получения фенола прямым каталитическим гидроксилированием бензола. Реакция прямого введения гидроксильной группы в бензольное ядро...
-
Реакции окисления и восстановления - Особенность синтеза фенолов
Окислительно-восстановительные реакции, также редокс -- это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов,...
-
Реакции с механизмом SN1 для ароматических соединений встречаются крайне редко и, по сути, характерны только для солей диазония. Эти реакции идут в...
-
Гидроксилирование аренов с реактивом Фентона - Особенность синтеза фенолов
Теоретически наиболее перспективным промышленным способом получения фенола является окисление бензола кислородом, однако до сих пор не найдено достаточно...
-
Метод жидкофазного окисления ацетальдегида азотной кислотой является одним из промышленных способов получения глиоксаля. Суммарное уравнение реакции...
-
Реакция окисления углерода - Основы теории окислительной плавки
Основная составляющая шихты при выплавке стали - чугун - содержит в среднем 4%. В готовой стали содержание углерода в большинстве случаев исчисляется...
-
Метод жидкофазного окисления ацетальдегида азотной кислотой является одним из промышленных способов получения глиоксаля. Суммарное уравнение реакции...
-
Щелочное плавление сульфокислот - Синтез фенола
При щелочном плавлении сульфокислот замещение сульфогруппы на оксигруппу считают результатом сложного процесса, предполагающего промежуточное...
-
Реакции ароматического нуклеофильного замещения Реакции SNAr (Ареновый механизм) Механизм реакции SNAr или реакции ароматического нуклеофильного...
-
Существуют разработки метода синтеза глиоксаля озонированием бензола эквивалентным количеством озона с дальнейшим гидрированием получаемых продуктов для...
-
Присоединение галогенов (Cl2,Br2) Гидроксильная группа оказывает очень большое влияние на ароматическое ядро, увеличивая его реакционную способность в О...
-
Существуют разработки метода синтеза глиоксаля озонированием бензола эквивалентным количеством озона с дальнейшим гидрированием получаемых продуктов для...
-
Введение, Химические свойства фенолов, Кислотные свойства фенолов - Особенность синтеза фенолов
Фенолы ( От греческого слова "фено" - "несущий свет") - органические соединения, содержащие атом гидроксила, связанный непосредственно с атомом углерода...
-
Запатентован способ получения глиоксаля окислением этиленгликоля в жидкой фазе при обработке кислородом или кислородсодержащим газом. Окисление проводят...
-
В промышленности синтез глиоксаля окислением этиленгликоля протекает в адиабатических условиях, оптимальный температурный режим процесса зависит от...
-
В промышленности синтез глиоксаля окислением этиленгликоля протекает в адиабатических условиях, оптимальный температурный режим процесса зависит от...
-
Запатентован способ получения глиоксаля окислением этиленгликоля в жидкой фазе при обработке кислородом или кислородсодержащим газом. Окисление проводят...
-
Как и все органические материалы, полимеры подвержены окислению. Это приводит к изменению вязкости, цвета, охрупчиванию изделий и ухудшению...
-
Окисление фосфора - Основы теории окислительной плавки
Как уже отмечалось, фосфор вредная примесь. Наличие его в стали понижает ее пластические свойства, свариваемость, повышает анизотропию механических...
-
График зависимости температуры потока 8 от расхода азота представлен на рисунке 2.2. На данном графике по оси абсцисс откладываются значения расхода...
-
Реакция окисления марганца - Основы теории окислительной плавки
Марганец в сталях присутствует как раскислитель и легирующий компонент. Раскислительная способность его мала и в этом качестве он используется при...
-
Лабораторные способы получения фенола - Синтез фенола
Метод получения 1: 2 моля бензойной кислоты, 2 моля пентагидрата сульфата меди и 900 мл воды нагревают в автоклаве со встряхиванием при 315 С в течение 1...
-
В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной...
-
Окисление глицерина, Синтез жирных кислот - Обмен и функции липидов
На первом этапе глицерин активируется в глицерофосфат, затем окисляется до фосфодигидроксиацетона, который через стадию образования пирувата переходит в...
-
Окисление природного газа и низших парафинов - Аналитический обзор получения формалина
Одним из способов получения формальдегида является окисление природного газа и низших парафинов. Данный способ с точки зрения доступности и дешевизны...
-
Сложные эфиры - Спирты и фенолы
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации, а полученные вещества - сложными эфирами данного спирта и данной кислоты....
-
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде...
-
Экстремальные условия На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Основной производственный метод получения формальдегида во всем мире уже много лет - каталитическое взаимодействие метанола с кислородом воздуха. В 20-х...
-
Реакции электрофильного замещения атомов водорода в ряду бензола - Типы связей в органической химии
1. Реакция галогенирования . Реакция галогенирования бензольного кольца осуществляется в присутствии катализаторов (чаще всего галогенидов железа или...
-
Производство азотной кислоты - Анализ и технологическая оценка химического производства
Безводная азотная кислота HNO3--тяжелая бесцветная жидкость плотностью 1520 Кг/м 3 (при 15° С). Она замерзает при температуре --47° С и кипит при 85°С,...
-
В России процесс окисления этиленгликоля с получением глиоксаля в промышленных масштабах не реализован, что обусловлено отсутствием соответствующих...
-
Механизм реакции, Растворители - Окисление по Байеру-Виллигеру
В 1948 г. Криге предположил, что реакция Байера-Виллигера протекает по ионному механизму. Первая стадия этого процесса, по-видимому, заключается в...
-
Строение и физико-химические свойства аскорбиновой кислоты - Аскорбиновая кислота
Аскорбиновая кислота (Acidumascorbinicum) - это белые кристаллы с резким кислым вкусом. Молекулярная масса = 176,13. Температура плавления аскорбиновой...
Окислительное декарбоксилирование карбоновых кислот, Окисление бензола закисью азота - Особенность синтеза фенолов