Строение и физико-химические свойства аскорбиновой кислоты - Аскорбиновая кислота
Аскорбиновая кислота (Acidumascorbinicum) - это белые кристаллы с резким кислым вкусом. Молекулярная масса = 176,13. Температура плавления аскорбиновой кислоты составляет 192°С (при нормальных условиях).
Растворимость аскорбиновой кислоты (грамм на 100 мл растворителя): 33,3 H2O, 2 EtOH. Аскорбиновая кислота практически нерастворима в диэтиловом эфире, хлороформе, бензоле, петролейном эфире. Водные растворы аскорбиновой кислоты имеют pH ~ 3 (pKa = 4,17); действует как моноосновная кислота. Аскорбиновая кислота мощный восстановитель, легко окисляется многими окислителями.
Водные растворы аскорбиновой кислоты устойчивы при отсутствии кислорода. На воздухе растворы аскорбиновой кислоты устойчивы при pH 5-6, очень неустойчивы при щелочном pH. [5]
Плотность 5% раствора аскорбиновой кислоты = 1,0180 г/мл
Ультрафиолетовый спектр поглощения 0,001% раствора раствора Аскорбиновая кислота в 0,1 М растворе хлористоводородной кислоты в области от 230 до 300 нм должен иметь максимум при 243 нм.{гф 12}
Удельное вращение 2% водного раствора от +22 о до +24О {Гф 11}; 10% раствора от +20,5 о до +21,5 о.
Таблица. Показатели преломления (n20D) и факторы показателей преломления (F) растворов кислоты аскорбиновой
|
Концентрация, % |
Показатели преломления, n20D |
Факторы показателей преломления, F |
|
1 |
1,3349 |
Для всех концентраций 0,00185 |
|
2 |
1,3367 | |
|
3 |
1,3386 | |
|
4 |
1,3404 | |
|
5 |
1,3423 | |
|
6 |
1,3441 | |
|
7 |
1,3460 | |
|
8 |
1,3478 |
Из-за наличия двух асимметрических атомов (в 4 и 5 положениях) существуют четыре энантиомера аскорбиновой кислоты. Две условно именуемые L- и D- формы хиральны относительно атома углерода в фурановом кольце.
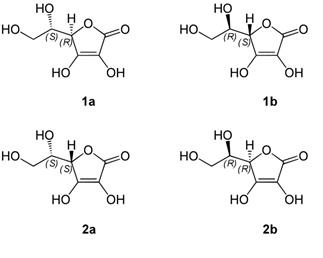
Рис 5. Оптические изомеры аскорбиновой кислоты:
- 1a-- L-Аскорбиновая кислота, 2a-- L-Изоаскорбиновая кислота, 1b-- D-Изоаскорбиновая кислота, 2b-- D-Аскорбиновая кислота
Биологически активной является L-(+)-форма. Д-(--)-форма является антивитамином и не существует в природе. Принятое строение аскорбиновой кислоты подтверждается рентгеноструктурным анализом. Кислотность обусловлена фенольной НО-группой. Аскорбиновая кислота легко отщепляет протон гидроксила в положении Сз кольца и по силе не уступает карбоновым кислотам:
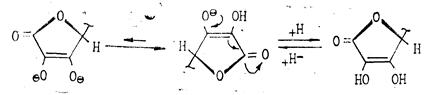
Рис.6
Аскорбиновая кислота является двухосновной, однако, ее считают практически одноосновной, поскольку pKI=4 12 а рКII =11,57.
Аскорбиновая кислота легко образует соли -- наиболее известна ее натриевая соль (аскорбинат натрия).
При нагревании со щелочами аскорбиновая кислота легко гидролизуется, превращаясь в соль 2-кето-L-гулоновой кислоты:
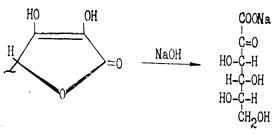
Рис.7
Аскорбиновая кислота очень легко окисляется и обладает сильной восстановительной способностью. Процесс окисления аскорбиновой кислоты протекает сложно, начальной стадией его является образование т. н. дегидроаскорбиновой кислоты под влиянием кислорода воздуха или других окислителей. Этот процесс является обратимым:
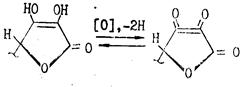
Рис.8
При рН<7 в процессе окислительного и гидролитического расщепления дегидроаскорбиновая кислота, например, превращается в 2,3-дикето-L-гулоновую кислоту. Последняя под влиянием повышенной температуры декарбоксилируется и превращается в L-ксилозон-2. Ксилозон восстанавливается аскорбиновой кислотой в L-ксилозу, которая циклизуется в фурфурол путем дегидратации:
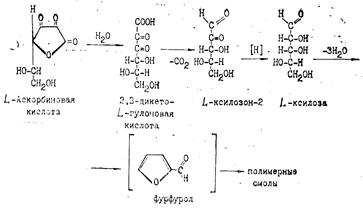
Рис.9
Известно, что фурфурол легко вступает в реакции присоединения, образуя полимеры, а также легко окисляется с раскрытием цикла и образованием янтарной и других органических кислот и смолистых веществ.
Указанные процессы протекают даже в присутствии кислорода воздуха, образуя цикл каталитического разложения аскорбиновой кислоты. Поэтому желательно исключить воздействие кислорода на растворы аскорбиновой кислоты и ее препараты в производстве и при хранении.
Естественно, что в присутствии более сильных окислителей и, особенно, ионов тяжелых металлов (медь, магний, железо) аскорбиновая кислота окисляется с деструкцией цикла и образованием в итоге различных органических кислот (L-трео-новая, глицериновая, щавелевая и др.). Все процессы окисления идут легче в щелочной среде.
Из других свойств аскорбиновой кислоты следует отметить ее способность к образованию простых и сложных эфиров. Наиболее известен пальмитат аскорбиновой кислоты, который используют для витаминизации пищевых продуктов:
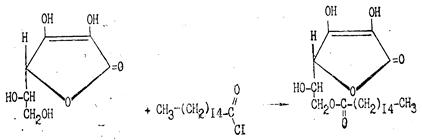
Рис.10
Похожие статьи
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Физико-химические свойства ртути - Ртуть: свойства и токсичность
Ртуть (Hg) - химический элемент II группы периодической системы элементов Д. И. Менделеева; атомный номер 80, относительная атомная масса 200,59; в...
-
Раствор кислоты аскорбиновой 5% (концентрированный раствор) Определение подлинности 1. К 4-5 каплям р-ра прибавляют 2-3 капли р-ра нитрата серебра;...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Способы получения и химические свойства кислот - Основы химии
Бескислородные кислоты получают: 1. Взаимодействием неметалла с водородом. Например H2 + Cl = 2HCl 2. Действием на соль более сильной или менее летучей...
-
Рассмотрим химические свойства тиосульфата натрия. Изучим его окислительно-восстановительные свойства, взаимодействие с кислотами, комплексообразование....
-
УМЯГЧЕНИЕ И ОБЕССОЛИВАНИЕ ВОДЫ - Химические свойства и строение воды
Под умягчением воды подразумевается процесс удаления из нее катионов жесткости, т. е. кальция и магния. В соответствии с ГОСТ 2874-82 "Вода питьевая"...
-
Оценка качества лекарственных средств, Определение подлинности - Аскорбиновая кислота
Определение подлинности Химический аскорбиновый кислота При определении подлинности используют восстановительные и кислотные свойства аскорбиновой...
-
Введение - Аскорбиновая кислота
Аскорбиновая кислота впервые выделена в чистом виде Сцент-Гиорги в 1928 г. под названием гексуроновая кислота. В 1933 г. рядом исследователей установлена...
-
Химические свойства, Физиологическое воздействие - Золото
Золото -- самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством...
-
Реакция с азотной кислотой (реакция нитрования) - Химические свойства насыщенных углеводородов
Концентрированная азотная кислота при нагревании окисляет насыщенные углеводороды, а на холоду - не действует на них. В 1889 г. М. И. Коновалов открыл,...
-
История открытия тиосульфата натрия, Строение молекулы и ее влияние на свойства - Тиосульфат натрия
Имя и время открытия тиосульфата натрия нам не известны. Во всяком случае в истории химии об этом не упоминается. Но в конце XVII и в начале XVIII века,...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Химические свойства, Список использованной литературы - Получение, строение и свойства полистирола
Химические свойства стирола обусловлены высокой реакционной способностью боковой винильной группы. Фенильное ядро затрагивается в процессе термической...
-
Испытания на чистоту, Количественное определение - Аскорбиновая кислота
В качестве допустимых примесей рассматривают сульфатную золу (не более 0,1 %) и тяжелые металлы (не более 0,001 %). Содержание органических примесей...
-
Органические кислоты в различных условиях могут разлагаться с образованием предельного углеводорода по общей схеме O R-C RH + CO2 Кислота OH Углеводород...
-
Источники и способы получения - Аскорбиновая кислота
Аскорбиновая кислота содержится в значительных количествах в овощах (салат, капуста), плодах, ягодах, хвое, шиповнике, в листьях черной смородины....
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Физико-химические свойства - Свойства флавоноидов
Флавоноиды являются кристаллическими веществами с определенной температурой плавления, без запаха, имеющие желтый (флавоны, флавонолы, халконы и др.),...
-
Физико-химические свойства кремния - Физические и химические свойства кремния
Кремний - это мелкий бурый порошок или серые, твердые, но довольно хрупкие кристаллы (пл. 2,4). В кристаллическом состоянии кремний хорошо проводит...
-
КОЛЛОИДНЫЕ ВЕЩЕСТВА ПРИРОДНЫХ ВОД И ИХ УДАЛЕНИЕ - Химические свойства и строение воды
Очистка сточных вод -- лишь одно из направлений защиты гидросферы, прежде всего, поверхностных вод от антропогенных загрязнений. Главный путь защиты...
-
ЖЕСТКОСТЬ ВОДЫ - Химические свойства и строение воды
Жесткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния, это...
-
ПРИРОДНЫЕ ВОДЫ И ИХ СОСТАВЫ - Химические свойства и строение воды
Водная среда включает поверхностные и подземные воды. Поверхностные воды в основном сосредоточены в океане, содержанием 1 млрд. 375 млн. кубических...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
ВВЕДЕНИЕ, СТРОЕНИЕ МОЛЕКУЛ И СВОЙСТВА ВОДЫ - Химические свойства и строение воды
Вода - ценнейший природный ресурс. Вода играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Химические свойства - Железо в деятельности человека
Основные степени окисления железа -- +2 и +3. При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида,...
-
Строение полистирола, Свойства полистирола - Получение, строение и свойства полистирола
Полистирол - термопластичный полимер преимущественно линейного строения с формулой [-СН 2 - С(С 6 Н 5)Н-]n и структурной формулой: Полистирол -...
-
Химическое строение, физико-химические и физические свойства лекарственных средств Свойства лекарственных средств в значительной степени обусловлены их...
-
Строение и свойства простагландинов - Простагландины. Строение. Биороль
ПРОСТАГЛАНДИНЫ (PG), биологически активные липиды, представляющие собой производные гипотетич. про-становой к-ты (ф-ла I) и различающиеся положением...
-
Строение, физические свойства, значение воды - Свойства водорода
Вода -- самое распространенное соединение водорода. Общая масса воды на нашей планете около 1,4*1018 т. Вода -- это единственное вещество, все три...
-
Газов в гомологическом ряду нет. Это жидкости. Начиная с С12Н25ОН до С20Н41ОН - маслообразные и с С21Н43ОН -- твердые вещества. Ткип СН3ОН=65 °С, Ткип...
-
Химические свойства - Титан и его физические свойства
Устойчив к коррозии благодаря оксидной пленке, но при измельчении в порошок горит на воздухе. Титан устойчив к разбавленным растворам многих кислот и...
-
Комплексные соединения, их номенклатура, типы, строение, свойства - Основы химии
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Согласно...
-
Физические и химические свойства - Магний и его сплавы. Резиновые материалы. Быстрорежущая сталь
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой...
-
ЗАКЛЮЧЕНИЕ, ЛИТЕРАТУРА - Химические свойства и строение воды
Совершенно очевидна потребность нашего населения в чистой, прозрачной, без цвета, вкуса и запаха, питьевой воде. Это позволит сохранить здоровье...
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Кислород: история открытия и основные свойства
Кислород - элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8....
-
Физические и химические свойства - Сера и ее роль в жизни
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S-S составляет...
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
Запасы этих растворов, несоответствующих показателям качества, исчисляются сотнями тысяч тонн и дальнейшее их хранение становится очень опасным для...
Строение и физико-химические свойства аскорбиновой кислоты - Аскорбиновая кислота