ФИЗИЧЕСКИЕ СВОЙСТВА БРОМИСТОГО ЭТИЛА, ХИМИЧЕСКИЕ СВОЙСТВА БРОМИСТОГО ЭТИЛА - Реакции замещения гидроксила предельных алифатических спиртов на галоген на примере синтеза бромистого этила
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде растворяется мало, с эфиром же и спиртом смешивается во всех пропорциях. При температуре красного каления пары бромистого этила разлагаются, образуя этилен и бромистый водород. При более высокой температуре этилен разлагается в свою очередь на H и C. Загорается трудно и горит зеленым коптящим пламенем, распространяя сильный запах бромистоводородной кислоты.
Плотность: 1,4555 (20°C, г/см3); 1,50138 (0°C, г/см3)
Показатель преломления (для D-линии натрия): 1,42386 (20°C)Стандартная энтальпия образования ДH (298 К, кДж/моль): -85,3 (ж) Стандартная мольная теплоемкость Cp (298 К, Дж/моль-K): 100,4 (ж) Температура вспышки в воздухе (°C): -25
Температура самовоспламенения на воздухе (°C): 455
Теплота сгорания Qp (кДж/моль):1424,8 [3]
ХИМИЧЕСКИЕ СВОЙСТВА БРОМИСТОГО ЭТИЛА
Азотная, концентрированная серная кислоты и калий не действуют на него. С аммиаком бромистый этил дает бромистоводородные соли этиламина, диэтиламина и триэтиламина. С анилином образует бромистоводородную соль этилфениламина (Hofmann). [4]
В воде, как и многие галогенпроизводные, медленно гидролизуется:
CH3CH2Br + H2O > CH3CH2?OH + HBr
С водными щелочами взаимодействие идет быстрее и двумя путями:
CH3CH2Br + NaOH > CH3CH2?OH + NaBr
CH3CH2Br + NaOH > CH2 = CH2?OH + NaBr +H2O
ПРИМЕНЕНИЕ
Бромистый этил используется:
- - как этилирующий агент в органическом синтезе; - как анестетик в медицине; - в качестве хладагента и фумиганта; - как растворитель; - как добавка к топливу и др. [4]
ПОЛУЧЕНИЕ
В лабораторных условиях галогеналкилы часто получают нуклеофильным замещением гидроксила в спирте на галоген. [3]
Для получения бромистого этила применяют этиловый спирт:
C2H5OH + KBr + H2SO4 > C2H5Br + KHSO4 + H2O.
При этом также протекают и побочные реакции:
2HBr + H2SO4 > Br2 + 2H2O + SO2^,
CH3CH2OSO3H + HOCH2CH3 > H2SO4 + CH3CH2OCH2CH3.
Для уменьшения потери продукта необходимо соблюдать условия проведения реакции.
МЕХАНИЗМ РЕАКЦИИ
Механизм нуклеофильного замещения в спиртах (катализатор - кислота). [3] галоидопроизводный углеводород органический бромэтил
Сильные кислоты - это доноры протонов (H+): H2SO4 = H+ + HSO4-
Спирты являются слабыми основаниями (акцепторами протона) за счет неподеленной пары электронов атома кислорода. Поэтому в присутствии сильной минеральной кислоты происходит протонирование спирта (образование донорно-акцепторной связи Н-О) (схема 1):
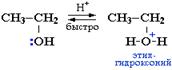
Далее возможно протекание реакции по одному из двух возможных механизмов.
Механизм I
I стадия. Катион алкилгидроксония, отщепляя воду, превращается в карбокатион (схема 2):
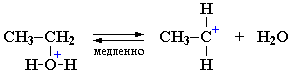
Роль кислоты, таким образом, заключается в превращении ОН-группы в Н2О, которая отщепляется легче, чем анион НО-.
II стадия. Карбокатион вызывает гетеролитический разрыв связи в галогеноводороде и присоединяет галогенид-анион с образованием конечного продукта (схема 3, схема 4):
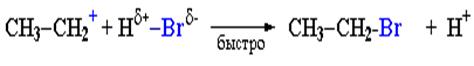
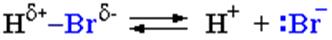
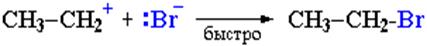
Освободившийся H+ идет на протонирование новых молекул спирта.
Механизм II.
Другой возможный механизм нуклеофильного замещения, представленный на схеме 5, заключается в практически одновременном отщеплении воды и присоединении галогена (без образования карбокатиона) и идет в одну стадию.
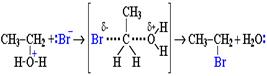
Механизм замещения зависит от строения реагентов и условий реакции. Для третичных спиртов предпочтительней первый механизм, а для первичных - второй.
На стадии, определяющей скорость реакции (так называемой, лимитирующей стадии), в механизме I образуется карбокатион. Чем стабильнее этот катион, тем легче он образуется. Третичный катион стабильнее, чем первичный (три +I-эффекта алкильных групп в третичном катионе и один - в первичном). С другой стороны, энергия переходного состояния в механизме II тем ниже, чем меньше стериотические препятствия, т. е. чем меньше алкильных групп у атакуемого атома углерода. [3]
Похожие статьи
-
Синтез бромэтана проводили в соответствии с методикой, изложенной в источнике [2]. ХОД РАБОТЫ - Приготовление исходных реактивов и собирание прибора Рис....
-
Галоидопроизводные углеводородов и других органических соединений широко применяются в качестве исходных веществ в ряде синтезов. Относительно большая...
-
Проба Бейльштейна. [6] Медную проволоку с загнутым в виде петельки концом прокаливают в пламени горелки для образования на поверхности слоя оксида меди...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
Химические свойства спиртов - Спирты и фенолы
Ряд химических свойств спиртов является общим для всех спиртов; имеются также и реакции, по-разному протекающие для первичных, вторичных и третичных...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Химические свойства. Образование ковалентной связи по донорно-акцепторному механизму - Аммиак
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус - синий; фенолфталеин - малиновый)...
-
Газов в гомологическом ряду нет. Это жидкости. Начиная с С12Н25ОН до С20Н41ОН - маслообразные и с С21Н43ОН -- твердые вещества. Ткип СН3ОН=65 °С, Ткип...
-
Органические кислоты в различных условиях могут разлагаться с образованием предельного углеводорода по общей схеме O R-C RH + CO2 Кислота OH Углеводород...
-
Физические свойства, Химические свойства - Арены. Толуол
Бензол и его ближайшие гомологи - бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Реакция с азотной кислотой (реакция нитрования) - Химические свойства насыщенных углеводородов
Концентрированная азотная кислота при нагревании окисляет насыщенные углеводороды, а на холоду - не действует на них. В 1889 г. М. И. Коновалов открыл,...
-
Физические свойства., Химические свойства. - Третья группа периодической системы
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло - и электропроводностью. Алюминий имеет невысокую плотность -- примерно...
-
Образование фенолятов, Реакции ароматического ядра фенолов - Спирты и фенолы
Образование простых эфиров фенолов алкилированием фенолятов: ArONa + RI > ArOR + NaI ArONa + (CH3O)2SO2 > ArOCH3 + CH3O-SO2ONa Образование...
-
Метиловый спирт [30] - Разработка технологической схемы получения анизола и крезола
Молекулярная формула CH3OH Молярная масса 32,04 г/моль Внешний вид бесцветная жидкость Свойства Плотность и агрегатное состояние 791,8 кг/м?,...
-
ФИЗИЧЕСКИЕ СВОЙСТВА, ХИМИЧЕСКИЕ СВОЙСТВА - Никель глазами химика
Металлический никель имеет серебристый цвет с желтоватым оттенком, очень тверд, вязкий и ковкий, хорошо полируется, притягивается магнитом, проявляя...
-
Физические и химические свойства - Сера и ее роль в жизни
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S-S составляет...
-
Взаимодействие с галогенами - Химические свойства насыщенных углеводородов
В обычных условиях хлор и бром реагируют с насыщенными углеводородами, но лишь очень медленно. Если встряхивать жидкий предельный углеводород с бромной...
-
Физические свойства, Общая химическая характеристика кадмия - История открытия и свойства кадмия
Кадмий _ Серебристо-белый , отливающий синевой Металл , тускнеющий на воздухе из-за образования защитной пленки оксида. Температура плавления - 321C,...
-
Химические свойства - Титан и его физические свойства
Устойчив к коррозии благодаря оксидной пленке, но при измельчении в порошок горит на воздухе. Титан устойчив к разбавленным растворам многих кислот и...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
Применение спиртов - Химические свойства и характеристики спиртов
Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений:...
-
Получение спиртов - Химические свойства и характеристики спиртов
Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать в противоположном направлении, приводя к получению...
-
Пластичными массами называют материалы, полученные на основе полимеров, содержащие различные добавки и способные под влиянием температуры и давления,...
-
Физические и химические свойства - Магний и его сплавы. Резиновые материалы. Быстрорежущая сталь
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой...
-
Химические свойства алюминия и его соединений - Алюминий и его свойства
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). I. Взаимодействие с простыми...
-
К числу физических факторов, вызывающих коррозию цементного камня и бетона, относят их попеременное увлажнение и высыхание, которое сопровождается...
-
Способы получения и химические свойства кислот - Основы химии
Бескислородные кислоты получают: 1. Взаимодействием неметалла с водородом. Например H2 + Cl = 2HCl 2. Действием на соль более сильной или менее летучей...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Химические свойства Магния. - Химический элемент Магний
Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина,...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Физические свойства, Химические свойства - Синтез оксида свинца
Платтенерит. Темно-коричневый, тяжелый, при слабом нагревании разлагается без плавления. Не реагирует с водой. Из раствора осаждается гидрат mPbO2ЧnH2O....
-
Методы анализа - Свойства флавоноидов
Качественное определение. Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и...
-
Понятие и классификация спиртов СПИРТЫ (алкоголи) - класс органических соединений, содержащих одну или несколько группировок С-ОН, при этом гидроксильная...
-
Получение, Изотопы, Физические свойства, Химические свойства - Краткие сведения о кобальте
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для...
-
Получение, Физические свойства, Химические свойства - Кальций и его биологическая роль
Свободный металлический кальций получают электролизом расплава, состоящего CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим...
-
Физические свойства Магния. - Химический элемент Магний
Физические свойства магния. Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти...
-
Большинство систем классификации растворителей по химическим признакам в явной либо неявной формах учитывает их кислотно-основные свойства. Поэтому самая...
ФИЗИЧЕСКИЕ СВОЙСТВА БРОМИСТОГО ЭТИЛА, ХИМИЧЕСКИЕ СВОЙСТВА БРОМИСТОГО ЭТИЛА - Реакции замещения гидроксила предельных алифатических спиртов на галоген на примере синтеза бромистого этила