Производство азотной кислоты - Анализ и технологическая оценка химического производства
Безводная азотная кислота HNO3--тяжелая бесцветная жидкость плотностью 1520 Кг/м3 (при 15° С). Она замерзает при температуре --47° С и кипит при 85°С, При кипении HNO3 частично разлагается с выделением двуокиси азота. С водой HNO3 смешивается в любых соотношениях, выделяя тепло, а с двуокисью азота образует нитроолеум.
Концентрированная кислота не реагирует с алюминием, хромом и даже железом, поэтому аппаратуру для получения азотной кислоты готовят из xpoмоникелевых сталей, алюминия или из стали, футерованной кислотоупорной керамикой.
Получение слабой азотной кислоты имеет две стадии;
- А) окисление аммиака до окиси азота N0; Б) переработка N0 в азотную кислоту.
Окисление аммиака проводятся при температуре 800--900°С в присутствии катализатора, изготовленного из сплава платины н родия (5--10%) в виде сеток, сплетенных из тонкой проволоки. Кроме платины, могут применяться менее активные катализаторы на основе окиси кобальта или железа с активирующими добавками. Аммиак может окисляться при 900°С и без катализатора, но в этом случае получается не окись азота, а азот:
4NH3 + 3О2 =2N3 + 6Н20 + Q.
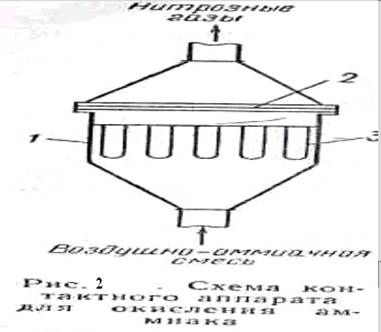
Катализаторы очень чувствительны к примесям сероводорода, пыли и т, д., поэтому воздух перед смешением с аммиаком тщательно очищается. На рис. 2 показана схема контактного аппарата для окисления аммиака под атмосферным давлением. Аппарат имеет корпус цилиндрической формы в ней закреплены платино-радиовые сотки (3--4 шт.) и поролитовые трубки (из пористой керамики) для очистки воздушко-амиачной смеси от пыли. Для получения окиси азота в контактный аппарат подают смесь, содержащую 10--11%. Повышать содержание амиака нельзя, так как при 20° С смесь с содержанием 15--28% NH3 становится взрывоопасной. При прохождении cmcеcи через платиновые сетки аммиак окисляется с образованием N0. Степень окисления аммиака составляет 98%.
Контактные аппараты, работающие под давлением 1,5--10 Am (9,81*104 Н/м2), мало отличаются от описанных выше, но в них имеется 16--20 сеток и аппаратура более толстостенная.
Переработка окиси азота в разбавленную азотную кислоту осуществляется следующим образом. Выходящие из контактного аппарата нитрозные газы охлаждаются, и окись азота N0 окисляется самопроизвольно кислородом:
2NO + О2 - > 2NO2 + Q.
Окисление NO в NO2 происходит очень медленно. Для увеличения скорости окисления необходимо понижать температуру (реакция аномальная, скорость растет при снижении температуры в отличие от других реакции) и испытать дарение (при увеличении давления с 1 до 10 Am скорость возрастает в 100U раз). Поэтому окисление N0 в N02 и абсорбцию NO2 часто происходит в установках, работающих под давлением 1,5--10 Am (0,15--1 Мн/м2), что резко сокращает объемы окислительно-абсорбционных башен.
Абсорбция двуокиси азота осуществляется водой по суммарному уравнению
3NO2+ Н2О - > 2НNО3 + NO + Q.
Нитрит натрия затем окисляется до нитрата натрия.
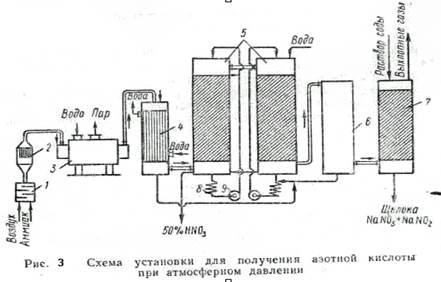
На рис. 3 показана принципиальная схема получения азотной кислоты при атмосферном давлении. Воздух и аммиак после очистки от примесей подаются в смеситель1, а затем в контактный аппарат 2. Для окисления амиака. Образовавшиеся нитрозные газы при температуре 800°С выходят из аппарата и, пройдя котел-утилизатор 3, oхлаждаются до 250°С и поступают в кожухотрубный холодильник 4, Где дополнительно охлаждаются до 30° С, В холодильнике начитаются окисление N0 до NO2 и конденсация пapoв, воды, при этом частично образуется HNO3
Из холодильника нитрозные газы направляются в абсорбционные насадочные башни 5, в которых окислы азота поглощаются водой; таких башен в системе б--8 шт. Прейдя последовательно через эти башни, газы поступают в окислительную башню б, где оставшаяся часть N0 окисляется в NO2 и затем а башни щелочной абсорбции 7. Для поглощения N0 последняя башня орошается водой. Образовавшаяся слабая кислота охлаждается в холодильниках 8 и с помощью насосов 9 проходит последовательно противотоком газу все поглотительные башни. Кислота (50% HNO3) выводится из первой по ходу газа башни. Степень переработки окислов азота в азотную кислоту составляет 92%, а остальные окислы азота улавливаются в башнях щелочной абсорбции.
В установках, работающих под давлением 1,5--10 Am (0,15-- 1 Мн/м2} и по комбинированной схеме, степень поглощения окислов азота водой составляет 99%, а получаемая кислота более крепкая -- 60--62%.
Похожие статьи
-
Полимеризация двуокиси азота. Переработка нитрозных газов в азотную кислоту обычно происходит при температурах от О до 50 °С. В этих условиях двуокись...
-
Азотный кислота утилизация оксид Методы получения азотной кислоты Первый завод по производству HNO3 из аммиака коксохимического производства был пущен в...
-
Синтезы на основе ацетилена - Анализ и технологическая оценка химического производства
Ацетилен СН=СН -- газ, легко вступающий в самые различные химические реакции с образованием многочисленных соединений, используемых при получении...
-
Технология производства соляной кислоты - Анализ и технологическая оценка химического производства
Соляная кислота--бесцветная жидкость, представляющая собой раствор хлористого водорода в воде. Она энергично растворяет многие металлы и их окислы. В...
-
Этот способ концентрирования обеспечивает получение чистой концентрированной азотной кислоты без вредных выбросов в атмосферу. Однако у него есть ряд...
-
Получение синтезированного газа - Анализ и технологическая оценка химического производства
Химические методы переработки нефти проводят при высоких температурах без катализатора (термический крекинг), при высоких температурах в присутствии...
-
Запасы этих растворов, несоответствующих показателям качества, исчисляются сотнями тысяч тонн и дальнейшее их хранение становится очень опасным для...
-
В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной...
-
Производство полимеров - Анализ и технологическая оценка химического производства
Высокомолекулярные соединения получают из мономеров полимеризацией, сополимеризацией, поликонденсацией и методами привитой полимеризации и...
-
Выбор метода производства (или выделение) готового продукта Современные методы производства азотной кислоты основаны на применении синтетического аммиака...
-
Подготовка угля к коксованию - Анализ и технологическая оценка химического производства
Коксование-- Процесс сухой перегонки каменных углей при их нагревании до 900--1050° С без доступа воздуха. В результате сложных физических и химических...
-
Производство пластмасс - Анализ и технологическая оценка химического производства
Пластические массы делят на простые (ненаполненные) и сложные (композиционные). Основу пластических масс составляет высокомолекулярное соединение --...
-
Схема 1. Технологическая схема производства серной кислоты по методу ДК. 1-серная печь; 2- котел-утилизатор; 3- экономайзер; 4- пусковая топка;...
-
Производство химических волокон - Анализ и технологическая оценка химического производства
Волокнами называют тела, длина которых во много раз превышает очень малые (микроны) размеры их поперечного сечения. По происхождению волокна делят на...
-
Азотная кислота широко применяется для производства многих продуктов, используемых в промышленности и сельском хозяйстве Список использованной литературы...
-
Введение - Производство нитратной кислоты АК-72. Анализ стадий переработки оксидов азота в HNO3
Азотная кислота - одна из важнейших минеральных кислот. По объему производства в химической промышленности она занимает второе место после серной...
-
Реакция с азотной кислотой (реакция нитрования) - Химические свойства насыщенных углеводородов
Концентрированная азотная кислота при нагревании окисляет насыщенные углеводороды, а на холоду - не действует на них. В 1889 г. М. И. Коновалов открыл,...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Температура кислоты, Защита от коррозии, Цвет кислоты - Работа сернокислотного производства
Значения температуры кислоты на входе в сушильную башню (7506U) отображаются на устройстве цифровой индикации TIC-750607 в операторной. Датчик...
-
Актуальность темы. В современных условиях глобальной конкуренции на все более интегрирующихся мировых рынках, развитие химической промышленности...
-
Описание процесса получения серной кислоты - Работа сернокислотного производства
Первая ступень мокрой очистки газа производится в cкруббере Вентури, где слабая 25 %-ная серная кислота для орошения газа подается насосами на два...
-
Реакция с реактивом Марки. К сухому остатку на фарфоровой чашке добавляют 1 каплю реактива Марки, наблюдают лимонно-желтое окрашивание, переходящее при...
-
ПОДГОТОВКА ОБЖИГОВОГО ГАЗА К КОНТАКТНОМУ ОКИСЛЕНИЮ. - Получение серной кислоты
Подготовка обжигового газа к контактному окислению заключается в удалении из него примесей, присутствие которых может вызвать затруднения при проведении...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
Технологическая схема производства - Пиролиз углеводородного сырья
В данном разделе излагается описание технологического процесса и технологической схемы отделения пиролиза углеводородов нефти. Сырье с температурой...
-
Агрегат АК-72М является модернизированным агрегатом АК-72 с изменением ряда узлов, направленным на повышение мощности и устранение выявленных в первые...
-
АБСОРБЦИЯ ТРИОКСИДА СЕРЫ. - Получение серной кислоты
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную...
-
Опыт проводили в условиях, имитирующих периодическую экстракцию: в стакан одновременно загружали все реагенты и перемешивают их в течение заданного...
-
Рассмотрим химические свойства тиосульфата натрия. Изучим его окислительно-восстановительные свойства, взаимодействие с кислотами, комплексообразование....
-
ПРОМЫШЛЕННОЕ ПРОИЗВОДСТВО: ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ - Технология получения винилхлорида
На 2010 год существуют четыре основных способа получения винилхлорида, реализованные в промышленных масштабах. Винилхлорид можно получить различными...
-
При кипячении с разведенной хлороводородной кислотой происходит процесс гидролиза с образованием бензгидрола: Обнаружение димедрола методом ТСХ....
-
В конце XIX в. началось промышленное производство молочной кислоты при участии молочнокислых бактерий Lactobacillus delbrueckii, L. leichmannii и L....
-
Введение - Бродильное производство органических кислот
Биомасса представляет собой сложную химическую систему, а большинство процессов и продуктов биотехнологии имеют биохимическую природу, будь то...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
К числу бактерий, способных вырабатывать салициловую кислоту (рис. 4.4) при росте в средах с нафталином, принадлежат многие виды Pseudomonas,...
-
Яблочную кислоту, которая применяется в качестве подкислителя в пищевой промышленности, можно получать из фумаровой либо путем ферментации при участии...
-
Процессы, основанные на микробиологической ферментации, разработаны и для получения ряда других органических кислот. Среди них -- глюконовая кислота и ее...
-
Производство лимонной кислоты методом ферментации - Бродильное производство органических кислот
Производство лимонной кислоты методом ферментации при участии грибов также принадлежит к числу давних биотехнологических процессов; оно было налажено в...
-
Уровень кислоты, Расход кислоты - Работа сернокислотного производства
Уровень кислоты в сушильной башне (7506U) должен поддерживаться в нормальном рабочем диапазоне, чтобы не допустить повреждение насоса и переполнение...
Производство азотной кислоты - Анализ и технологическая оценка химического производства