Адсорбция. Виды адсорбции. Уравнения Ленгмюра и Фрейндлиха - Поверхностные явления. Адсорбция
Адсорбция - концентрирование вещества из объема фаз на поверхности раздела между ними. Адсорбция может рассматриваться как Поглощение вещества (адсорбата) поверхностью адсорбента.
Адсорбент - вещество, на поверхности которого протекает адсорбция.
Адсорбтив - Газ или растворенное вещество, способное адсорбироваться на поверхности адсорбента.
Адсорбат - Адсорбированное вещество, находящееся на поверхности адсорбента. Часто понятия "адсорбтив" "адсорбат" отождествляются
Различают Физическую адсорбцию, Происходящую без химического изменения адсорбата и Химическую адсорбцию (хемосорбцию), сопровождающуюся химическим взаимодействием адсорбтива с адсорбентом.
Адсорбция бывает на границах раздела фаз: твердое тело - жидкость, твердое тело - газ, жидкость - газ, жидкость - жидкость.
Если вещество адсорбируется в виде молекул, говорят о Молекулярной Адсорбции, в виде ионов - Ионной адсорбции.
Адсорбция - обратима, обратный процесс называют Десорбцией.
Скорости адсорбции и десорбции равны между собой при Адсорбционном равновесии, которому соответствует Равновесная концентрация адсорбата в растворе или Равновесное давление в газовой фазе.
Величина адсорбции (А) характеризуется равновесным количеством поглощаемого вещества (Х), приходящимся на единицу массы твердого адсорбента (m): [моль/кг или кг/кг]

Изотерма адсорбции - графическое отображение зависимости величины адсорбции от равновесной концентрации или равновесного давления при данной постоянной температуре.
Различают адсорбцию Мономолекулярную, при которой адсорбат покрывает поверхность адсорбента слоем толщиной в одну молекулу и Полимолекулярную, при которой молекулы адсорбата могут располагаться на поверхности адсорбента в несколько слоев.
Изотерма мономолекулярной адсорбции Имеет вид, изображенный на рис.12 (Изотерма Ленгмюра)
А Участок I - отвечает Малым равновесным концентрациям (давлениям), когда небольшая часть поверхности адсорбента занята молекулами адсорбата, а зависимость А - с (р) линейна;
АУчасток II - Средним концентрациям (давлениям) при которых значительная доля поверхности адсорбента занята молекулами адсорбата;
C (р) Участок III - наблюдается при Высоких равновесных концентрациях (давлениях), когда вся поверхность адсорбента занята молекулами адсорбата и достигнута Предельная величина адсорбции (А).
Изотерма мономолекулярной адсорбции хорошо Описывается уравнением Ленгмюра:

или



Где В, А константы, индивидуальные для каждого отдельного вещества при адсорбции на конкретном адсорбенте;
С, р - равновесная концентрация или равновесное давление.
При малых равновесных концентрациях можно пренебречь величиной С или Р в знаменателе. Тогда уравнение Ленгмюра преобразуется в уравнение прямой, проходящей через начало координат:
А = А в с Или А =А в р
При больших равновесных концентрациях Можно пренебречь в знаменателе величиной В. Тогда уравнение Ленгмюра преобразуется в уравнение прямой не зависящей от С Или Р: А = А

Для практических расчетов Необходимо знать константы уравнения Ленгмюра А и В. Преобразование уравнения в линейную форму прямой, не проходящей через начало координат: , позволяет строить график зависимости 1/А - 1/с (рис.13).
1/А Отрезок ОВ равен 1/А. Коэффициент В Можно найти, исходя из того, что В равен концентрации, при которой величина адсорбции составляет половину от предельной.

Рис. 13.
На графике интерполяцией определяется отрезок ОД, соответствующий 2/А и равный 1/в. Тогда в = 1/ОД.
Уравнение Ленгмюра было выведено на основе теории мономолекулярной адсорбции, которая имеет следующие Основные положения:
Адсорбция молекул происходит только на адсорбционных центрах (вершины неровностей и узкие поры);
Каждый адсорбционный центр может удерживать только одну молекулу адсорбата;
Процесс адсорбции обратим; адсорбционное равновесие носит динамический характер. Адсорбированные молекулы удерживаются адсорбционными центрами только определенное время, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
Кроме уравнения Ленгмюра на практике часто используется Уравнение Фрейндлиха:
А = КС1/n Или А = КР1/n, где К и 1/n - константы эмпирические.
Уравнение более подходит для описания Адсорбции на Пористых или Порошкообразных адсорбентах в области Средних концентраций (давлений).
Изотерма адсорбции Фрейндлиха не имеет горизонтальной прямой и адсорбция с ростом концентрации (давления) увеличивается (рис. 14).
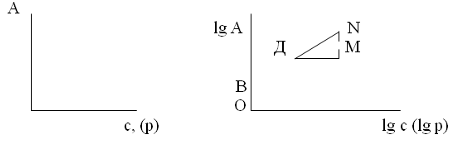
Рис. 14 Рис.15
Для Нахождения констант уравнения Фрейндлиха Оно преобразуется с помощью логарифмирования в уравнение прямой, не проходящей через начало координат: lg А = lg К + 1/n lg С.

В соответствии с этим график зависимости lg А от lg С или (Р), построенный по экспериментальным данным имеет вид, показанный на рис. 15. Экстраполяцией на ось ординат получают отрезок ОВ равный lg К. Тангенс угла наклона прямой ВN к оси абсцисс равен 1/n (Tg = )
Полимолекулярная адсорбция - наблюдается при адсорбции на пористых или порошкообразных адсорбентах (силикагель, активированный уголь, порошки и таблетки лекарственных веществ). В этом случае адсорбция продолжается до образования плотного мономолекулярного слоя, как показано на рис. 16.
Рис. 16. С, (р)

Рис. 17.
Такой адсорбции отвечает изотерма другого вида (рис. 17), так называемая "S - изотерма".
Капиллярная конденсация - явление сжижения пара в порах или капиллярах твердого адсорбента, она наблюдается при поглощении легко сжижающихся газов или паров (например, воды, бензола и др.) в результате полимолекулярной адсорбции. При этом Полимолекулярный слой Представляет собой тончайшую пленку жидкости, Покрывающую внутреннюю поверхность поры. Сливающиеся друг с другом в узких местах слои такой жидкости образуют вогнутые мениски, под которыми Создается пониженное давление пара. Благодаря этому Поры втягивают в себя молекулы газа (пара) и Заполняются жидкостью, образующейся при конденсации.
При протекании адсорбции, осложненной капиллярной конденсацией, Изотерма отвечающая заполнению пор (1) не совпадает с изотермой (2), отвечающей их опорожнению (рис.18). На изотерме образуется Петля конденсационного гистерезиса. Процессы адсорбции и десорбции не совпадают.

Рис. 18.
Похожие статьи
-
Свойства поверхностно-активных веществ - Поверхностные явления. Адсорбция
На поверхности раздела фаз молекулы ПАВ Ориентируются Гидрофильной группой в сторону полярной фазы, олеофильной - в сторону неполярной. Из-за Малого...
-
Адсорбция на границе жидкость - газ Сорбцией (от лат. "sorbeo" - поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорбтива) другим...
-
Адсорбция Лэгмюра и Фрейндлиха
Адсорбция. Изотермы адсорбции Лэгмюра, Фрейндлиха. Уравнение БЭТ и его анализ Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается...
-
Адсорбция активированный уголь Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и...
-
Сталагмометрический способ Определения поверхностного натяжения жидкостей (метод счета капель) основан на зависимости числа капель (n), полученных при...
-
Мицеллообразование. Критическая концентрация мицеллообразования Агрегация Молекул в некоторых водных растворах ПАВ при определенных концентрациях (10-5 -...
-
Когезия. Адгезия. Растекание. Смачивание Когезия - Явление притяжения (сцепления) частиц вещества: атомов, молекул, ионов - Внутри одной фазы. Работа,...
-
Способы определения ККМ Основаны на изменении свойств растворов ПАВ в мицеллярном состоянии: светорассеяния, показателя преломления, электропроводимости,...
-
План-конспект теоретической самоподготовки Поверхностное натяжение Состояние молекул вещества, находящегося в поверхностном слое твердого тела или...
-
Поверхностный натяжение адсорбция адгезия Поверхностное натяжение различных конденсированных тел на границе с газом непосредственно связано с межатомным...
-
Газовый хроматография энтропия адсорбция Области физико-химических применений газовой хроматографии Газовая хроматография, имеющая главным образом...
-
Адгезия, смачивание и растекание относятся к межфазным взаимодействиям, которые происходят между конденсированными фазами. Адгезия. Межфазное...
-
ПАВ и ПИВ - Коллоидные поверхностно-активные вещества
Одним из основных свойств поверхностно-активных веществ является их способность адсорбироваться из объема жидкости, где они растворены, на поверхности...
-
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия,...
-
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов...
-
Адсорбенты Применяемые адсорбенты характеризуются адсорбционной активностью, истинной и насыпной плотностью, удельной поверхностью общим объемом пор и их...
-
Заключение - Коллоидные поверхностно-активные вещества
Мировое производство ПАВ постоянно возрастает, причем доля неионных и катионных веществ в общем выпуске все время увеличивается. В зависимости от...
-
Оптическая геометрия нефелометров - Коллоидные поверхностно-активные вещества
Третий компонент, влияющий на качество показаний нефелометров - это оптическая геометрия, которая включает в себя параметры конструкции прибора, такие...
-
Концепция гидрофильно-липофильного баланса - Коллоидные поверхностно-активные вещества
В эмульсионной технологии существует эмпирическое правило: водорастворимые эмульгаторы обычно образуют эмульсии "масло в воде", в то время как...
-
Количественный анализ, Явления, искажающие вид полярограмм - Электрохимические методы анализа
Количественной характеристикой полярограммы является величина предельного диффузионного тока, которая зависит не только от концентрации иона, но и от...
-
Способность минералов закрепляться на поверхности раздела воздух - вода (или в общем случае газ - жидкость) зависит от степени полярности минеральной...
-
Введение - Коллоидные поверхностно-активные вещества
Поверхностно-активные вещества (ПАВ) -- химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного...
-
Прежде чем рассмотреть отдельные типы химических реакторов в соответствии с приведенной классификацией, составим уравнение материального баланса по...
-
Различают типы уравнений в зависимости от соотношения между коэффициентами. 1) При a=b=c=f=0, d не 0, e не 0 получаем уравнение первого порядка вида...
-
Для более сложных физических явлений, таких как процессы колебания, волновые процессы, процессы теплопроводности не всегда удается построить такие...
-
УРАВНЕНИЕ ПЛОСКОСТИ Любая Поверхность есть геометрическое место точек, ее составляющих, определенное уравнением Иными словами, все точки, которые...
-
При формировании узловых уравнений следует пронумеровать узлы анализируемой цепи. В качестве опорного узла с индексом "0", относительно которого...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Основные уравнения модели - Математическое моделирование процесса ректификации
Модель содержит следующие уравнения. Для тарелки i: (число тарелок равно N, нумерация тарелок - снизу вверх, куб считается нулевой тарелкой, дефлегматор...
-
Определение теплоты и энтропии адсорбции или растворения на основе хроматографических измерений Коэффициент адсорбции Г и коэффициент распределения К -...
-
Неионогенные ПАВ - Коллоидные поверхностно-активные вещества
Неионогенные ПАВ - высокомолекулярные соединения, не образующие ионов в водном растворе. Их растворимость обусловлена наличием в молекулах гидрофильных...
-
Причинность, регрессия, корреляция Исследование объективно существующих зависимостей и взаимосвязей между явлениями и процессами - важнейшая задача...
-
Основные уравнения, движущая сила процесса - Процесс фильтрования
Фильтрование протекает в ламинарной области, что означает небольшой размер пор в слое осадка и фильтровальной перегородке, а также малую скорость...
-
Описание процессов, происходящих на поверхности, изобилует специальными терминами, и при рассмотрении адсорбционных явлений приходится говорить на языке,...
-
Знаменитая теория полимолекулярной адсорбции Брунауэра, Эммета и Теллера, получившая название теории БЭТ (по первым буквам фамилий ученых), основана на...
-
Реагенты Продукты, Все химические реакции обратимы, Вопросы - Химическое равновесие
Все химические реакции обратимы Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом...
-
Матричный узловой цепь Недостатком метода расчета, основанного на непосредственном решении уравнений электрической цепи, является необходимость...
-
Ионные уравнения - Классы неорганических соединений
В растворах электролитов реакции происходят между гидратированными ионами, поэтому их называют ионными реакциями. В направлении их важное значение имеют...
-
Специфические способы определения удельной свободной поверхностной энергии - Коллоидная химия
Поверхностная энергия , энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме. При увеличении поверхности раздела...
-
На рис. 8 изображена схема газового хроматографа ХЛ-4. Выходящий из баллона газ-носитель проходит через осушитель 3, дроссель 4, ротаметр 5 и попадает в...
Адсорбция. Виды адсорбции. Уравнения Ленгмюра и Фрейндлиха - Поверхностные явления. Адсорбция