Концепция гидрофильно-липофильного баланса - Коллоидные поверхностно-активные вещества
В эмульсионной технологии существует эмпирическое правило: водорастворимые эмульгаторы обычно образуют эмульсии "масло в воде", в то время как маслорастворимые эмульгаторы -- эмульсии "вода в масле". Эта концепция известна как правило Банкрофта. Правило Банкрофта сугубо качественное. Гриффин, пытаясь превратить его в некоторое количественное соотношение между гидрофильностью ПАВ и его функциями в растворе, предложил концепцию гидрофильно-липофильного баланса поверхностно-активного вещества. Числа ГЛБ для нормальных неионных ПАВ определеляются следующими простыми расчетами.
1) Для этоксилированных спиртов и этоксилированных алкилфенолов:

2) Для этоксилированных многоатомных спиртов:

3) Для сложных эфиров жирных кислот и многоатомных спиртов:

Концепция чисел ГЛБ Гриффина впоследствии была развита Девисом, который ввел схему, позволяющую приписывать групповые числа ГЛБ химическим группам, составляющим молекулу ПАВ. Формула Девиса и значения некоторых типичных групповых чисел приведены в табл. 1. Из этой таблицы видно, что сульфатная группа потенциально намного более полярна, чем карбоксильная, и что концевая гидроксильная группа полиоксиэтиленовой цепи более гидрофильна, нежели гидроксильная группа Сахаров.
Таблица1 - Значения некоторых типичных групповых чисел

Концепция чисел ГЛБ, особенно в версии Гриффина, оказалась полезной при первичном отборе ПАВ для определенных целей. Эмульгатор для эмульсии "вода в масле" должен быть гидрофобным с числом ГЛБ 3-6, а эмульгатор для эмульсии "масло в воде" должен иметь числа ГЛБ в интервале 8-18. Это находится в хорошем согласии с правилом Банк-рофта. Для комнатной температуры числа ГЛБ, рассчитанные по Гриффину или по Девису, позволяют выбрать эмульгатор, что будет показано ниже. Проблема возникает при повышении температуры в процессе эмульгирования или при хранении готовой эмульсии при низких температурах. Полиоксиэтилированные неионные ПАВ чрезвычайно чувствительны к температуре. Многие из них образуют эмульсию типа "масло в воде" при обычных температурах и типа "вода в масле" -- при повышенных температурах. Такие факторы, как концентрация электролита в водной фазе, полярность масла и соотношение воды и масла, влияют на тип образующейся эмульсии. Очевидно, что числа ГЛБ невозможно использовать как универсальный способ выбора эмульгатора или определения типа эмульсии, которая образуется с данным ПАВ.
Метод ГЛБ - приближенный, но простой способ выбора эмульгатора:
Эмпирически было установлено, что для получения устойчивой эмульсии комбинация ПАВ, одного более гидрофильного, а другого более гидрофобного, оказывается более эффективной, чем использование одного ПАВ с промежуточными числами ГЛБ. Вероятнее всего, комбинация ПАВ с сильно различающимися значениями КПУ обеспечивает лучшую упаковку ПАВ на межфазной поверхности по сравнению с упаковкой индивидуального ПАВ. Преимущество смеси ПАВ может быть также связано со скоростью подвода ПАВ к межфазной поверхности. В присутствии маслорастворимых и водорастворимых эмульгаторов к вновь создающейся межфазной поверхности стабилизирующие ее ПАВ подводятся одновременно с двух сторон. Независимо от механизма использование комбинации ПАВ с низкими и высокими числами ГЛБ для получения эмульсий оказывается очень эффективным и часто применяется на практике. Типичный пример такой комбинации приведен на рис. 7.
Ряд общих правил подбора ПАВ-эмульгатора можно сформулировать следующим образом.
- 1) Поверхностно-активное вещество должно обладать сильно выраженной склонностью мигрировать к межфазной поверхности. 2) Маслорастворимые ПАВ преимущественно образуют эмульсии "вода в масле". 3) Устойчивые эмульсии часто образуются при использовании смеси гидрофильного и гидрофобного ПАВ. 4) Чем более полярна масляная фаза, тем выше должна быть гидрофильность эмульгатора.
Числа ГЛБ приписаны различным часто эмульгируемым веществам: растительным маслам, парафинам, ксилолу и др. Эти числа получены из экспериментов по эмульгированию: вещества эмульгируются с различными гомологами неионных ПАВ и определяются значение числа ГЛБ для оптимального ПАВ. В таблице 3 приведены числа ГЛБ наиболее распространенных "масел". В процессе эмульгирования эмульгатор или комбинация эмульгаторов должны быть выбраны с числом ГЛБ, равным числу ГЛБ фазы, которую нужно эмульгировать. При использовании смесей ПАВ ее ГЛБ определяется как средневзвешенное число из чисел ГЛБ индивидуальных ПАВ. Пример использования метода ГЛБ для выбора эмульгатора приведен на рис. 7.

Рис. 7. Пример использования метода ГЛБ для подбора эмульгатора
Несмотря на то, что метод ГЛБ полезен для предварительного выбора эмульгатора, он имеет ряд ограничений. Например, он совершенно непригоден, если при эмульгировании происходит изменение температуры. Кроме того, на эффективность такого подхода сильно влияют следующие факторы:
- 1) примеси в масле; 2) электролит в воде; 3) присутствие ко-ПАВ или других веществ.
Концепция температуры инверсии фаз:
Физико-химические свойства неионных ПАВ с полиоксиэтиленовыми цепями сильно зависят от температуры. Одно и то же ПАВ может стабилизировать эмульсии с водой в качестве дисперсионной среды при низких температурах и с маслом в качестве дисперсионной среды при высоких температурах. Концепция, в основе которой лежит температура инверсии фаз, определила более количественный подход для оценки эмульсионных систем, стабилизированных ПАВ. Принята следующая процедура для определения ТИФ: эмульсию масла в воде, содержащей -5% неионного ПАВ, встряхивают при повышении температуры. Температуру, при которой происходит инверсия фаз и эмульсия "масло в воде" переходит в эмульсию "вода в масле" определяют как ТИФ системы. Инверсию фаз можно легко определить по резкому падению электропроводности, когда эмульсия с водной дисперсионной средой трансформируется в эмульсию с масляной дисперсионной средой. В лабораторных условиях ТИФ определяют, как правило, используя модельные неионные ПАВ с узким гомологическим распределением. В связи с этим важно заметить, что ТИФ такого НПАВ отличается от ТИФ технических НПАВ с тем же средним числом этоксилирования. Разница особенно велика для НПАВ с относительно короткими полиоксиэтиленовыми цепями. Это объясняется тем, что в составе ПАВ с широким гомологическим распределением дифильные молекулы с короткими полиоксиэтиленовыми цепями преимущественно растворяются в масляной фазе, а фракции с длинными полиоксиэтиленовыми цепями в значительной мере растворяются в водной фазе. Обычно растворимость в масляной фазе больше, чем в водной фазе, поэтому большая доля ПАВ "потеряется" в масляной фазе, а ПАВ, адсорбированное на межфазной поверхности, окажется более гидрофильным, чем "усредненное ПАВ", введенное в систему. Следовательно, ТИФ будет выше, чем при отсутствии такого фракционирования. Распределение между водной и масляной фазами происходит и для индивидуального поверхностно-активного гомолога, но это не влияет на температуру инверсии фаз, поскольку во всех фазах -- в водной, масляной и на границе раздела фаз -- присутствуют одни и те же молекулы. В то время как число ГЛБ является характеристикой свойств изолированной молекулы ПАВ, ТИФ характеризует свойства эмульсии, в которой гидрофиль-но-липофильные свойства неионного поверхностно-активного вещества, использованного в качестве эмульгатора, полностью сбалансированы. Безусловно, между ТИФ и числами ГЛБ имеется корреляция. Увеличение длины полиок-сиэтиленовой цепи в неионных поверхностно-активных веществах приводит к увеличению чисел ГЛБ и увеличению ТИФ. Другие факторы, влияющие на ТИФ, таковы.
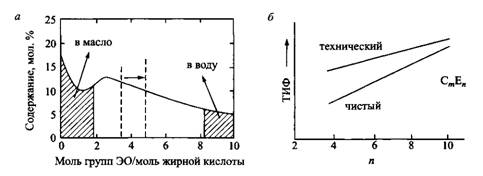
Рис. 8. Для технических этоксилированных спиртов характерна более высокая температура инверсии фаз, чем для индивидуального ПАВ с той же средней степенью этоксилирования. Разница в ТИФ связана с распределением гидрофильных и гидрофобных фракций в масле и воде соответственно. Большая доля ПАВ переходит в масло, а не в воду.
- 1) Природа масла. Чем менее полярно масло, тем выше ТИФ. Например, у этоксилированного нонилфенола в системе бензол-вода при соотношении жидких фаз 1:1 ТИФ равна ~ 20 °С. При замене бензола на циклогексан ТИФ возрастает до 70 °С, при замене масляной фазы на гексадекан ТИФ превышает 100 °С. 2) Концентрация электролита и тип соли. ТИФ понижается при добавлении большинства солей. Замена дистиллированной воды на 5%-ный раствор хлорида натрия приводит к понижению ТИФ почти на 10 °С. Зависимость ТИФ от концентрации и типа соли аналогична зависимости, характерной для точки помутнения. 3) Добавки в масляной фазе. Добавки, приводящие к увеличению полярности масла, например жирные кислоты или спирты, заметно снижают ТИФ. Добавки, хорошо растворимые в воде, например этанол и изопропанол, оказывают на ТИФ противоположное влияние. 4) Соотношение объемов масла и воды. Можно считать, что точка инверсии фаз индивидуального НПАВ не зависит от соотношения объемов масла и воды в интервале от 0.2 до 0.8. В случае технических поверхностно-активных веществ, которые содержат гомологи с разными числами ГЛБ, соотношение объемов жидких фаз влияет на распределение компонентов смеси ПАВ между жидкими фазами, приводя к увеличению ТИФ с увеличением соотношения объемов масло/вода. Если измерить ТИФ при различных соотношениях объемов жидких фаз и экстраполировать эту зависимость к нулевому соотношению объемов масла/вода, то полученное значение в первом приближении соответствует точке помутнения поверхностно-активного вещества. Эти эффекты находятся в полном согласии с правилом Банкрофта, т. е. с тем, что растворимость эмульгатора контролирует процесс эмульгирования. Так, добавление полярного, растворимого в масле органического компонента приводит к увеличению полярности масляной фазы, что в свою очередь приводит к увеличению растворимости в масле поверхностно-активного вещества. Правило Банкрофта утверждает, что в этих условиях преимущественно образуются эмульсии типа "вода в масле". Для получения сбалансированной системы необходимо усилить растворимость поверхностно-активного вещества в воде, что достигается понижением температуры, поскольку НПАВ, содержащие полиоксиэтиленовые цепи, сильнее растворяются в воде при пониженных температурах. Введение добавок понижает ТИФ.
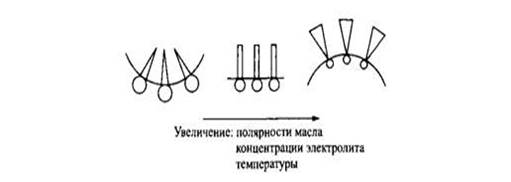
Рис. 9. Влияние полярности масла, концентрации электролита и температуры на кривизну межфазной границы масло-вода.
Подбор эмульгатора методом определения ТИФ
Коллоидный раствор активный эмульгатор
Межфазное натяжение на поверхности масло-вода минимально при температуре инверсии фаз. Эмульсии, образующиеся при этой температуре, тонкодисперсные, но неустойчивые по отношению к коалесценции. Пользуясь методом определения ТИФ, для эмульгирования выбирают такой эмульгатор, который имеет точку ТИФ примерно на 40 0C выше температуры хранения готовой эмульсии, полученной при одинаковых объемах жидких фаз и 5%-ном содержании НПАВ. Эмульгирование проводят при температуре на 2-4 0C ниже ТИФ, а затем эмульсию быстро охлаждают до температуры хранения, при которой коалесценция протекает с низкой скоростью. Эффективный способ охлаждения состоит в том, что эмульгирование проводят в относительно небольшом количеством воды, а затем добавляют холодную воду. Можно также получить эмульсию при температуре немного выше ТИФ, при этом образуется эмульсия "вода в масле". Затем добавляют холодную воду, что приводит к инверсии фаз с образованием эмульсии "масло в воде". Этот способ обычно используют при эмульгировании очень вязких масел, например алкидных и других смол, однако капли в эмульсиях при этом не такие маленькие, как при использовании метода ТИФ без инверсии фаз.
Различные типы неионных ПАВ как эмульгаторы:
Традиционно в качестве эмульгаторов использовали этоксилированные алкил-фенолы. Из-за пристального внимания к вопросам биоразлагаемости и токсичности в водной среде эти НПАВ были вытеснены этоксилированными спиртами с примерно такими же числами ГЛБ. Иногда такая замена не является адекватной, что можно объяснить различием структур гидрофобных частей НПАВ этих двух типов. Гидрофобный радикал в этоксилированных спиртах обычно представлен неразветвленными углеводородными цепями алифатических углеводородов, а этоксилированные алкилфенолы содержат объемный и сильно поляризующийся гидрофобный "хвост". Адсорбция поверхностно-активного вещества на межфазной границе определяется его молекулярной структурой. По сравнению с размером молекул ПАВ межфазную границу масло-вода на эмульсионной капле можно считать плоской. Следовательно, чтобы получить оптимальную упаковку молекул ПАВ на межфазной границе, которая контролирует устойчивость эмульсий, молекулы поверхностно-активного вещества должны иметь такую геометрию, чтобы размер полярной группы был приблизительно одинаковым с размером гидрофобного "хвоста". Другими словами, значение КПУ такого ПАВ должно быть близким к единице. Легко увидеть, например рассматривая молекулярные модели, что у линейных этоксилированных спиртов, обычно использующихся в качестве эмульгаторов при получении эмульсий "масло в воде", объем гидрофобного "хвоста" намного меньше объема полярной группы. У соответствующих этоксилированных алкилфенолов объем гидрофобных "хвостов" также меньше, чем объем полярной группы, но это различие не столь большое. Поэтому линейные этоксилированные жирные спирты хуже упаковываются на границах раздела фаз, чем этоксилированные алкилфенолы. Различие в упаковке молекул данных НПАВ на межфазных границах можно объяснить также тем, что движущая сила адсорбции таких этоксилированных спиртов меньше, чем для этоксилированных алкилфенолов. Этоксилированные спирты, молекулы которых содержат гидрофобные разветвленные фрагменты, характеризуются более сбалансированной геометрией, чем их линейные аналоги. Так называемые "спирты Гербе" -- спирты с длинными боковыми цепями у второго атома углерода, являются перспективным сырьем для получения сбалансированных этоксилированных спиртов. Было установлено, что такие НПАВ потенциально могут заменить этоксилированные алкилфенолы в разнообразных практических целях. Спирты с боковыми метальными группами, получаемые в процессе "оксосинтеза", представляют другой тип разветвленных спиртов.
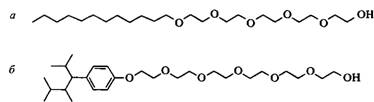
Рис. 10. Структуры нормальных этоксилированных спиртов и этоксилированного нонилфенола.
Еще одно различие между этоксилированными нонилфенолами и этоксили-рованными спиртами -- это наличие шести р-электронов в гидрофобной части нонилфенолов, что влияет на взаимодействия между ПАВ и ненасыщенными компонентами масла. Известно, что фенолы способны выступать донорами электронов при образовании донорно-акцепторых комплексов, предоставляя р-электроны молекулам-акцепторам электронов. Это взаимодействие может быть достаточно сильным, хотя природа связи до конца не ясна. Разумно предположить, что при взаимодействии этоксилированных алкилфенолов с двойной связью молекул, находящихся в масляной фазе, образуются такие комплексы, чего не может быть в случае этоксилированных спиртов. Образование донорно-акцепторного комплекса с участием этоксилированного нонилфенола показано на рис. 11.Электронные эффекты не настолько вездесущи, как эффекты геометрической упаковки. Донорно-акцепторные комплексы могут возникать только в том случае, если масло содержит компоненты, способные выступать как акцепторы электронов. Такими компонентами могут быть олефины и ароматические соединения, особенно содержащие группы, способные оттягивать электроны. Множество пищевых эмульсий, как и многие технические эмульсии, содержат масла с ненасыщенными компонентами. Образование комплексов способствует усилению взаимодействия между эмульгатором и масляной фазой. В свою очередь это позволяет использовать поверхностно-активные вещества с немного более длинными полиоксиэтиленовыми цепями, чем обычно. Более длинные оксиэтиленовые цепи обеспечивают более высокую растворимость поверхностно-активного вещества в воде. Такие ПАВ, не дающие дополнительного вклада в гидрофобные взаимодействия неполярных радикалов с маслом, преимущественно находятся в водной фазе. Использование поверхностно-активных веществ с более длинными оксиэтиленовыми цепями выгодно, поскольку такие цепи обеспечивают сильное стерическое отталкивание между каплями, предотвращая их коалесценцию.
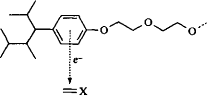
Рис. 11. Электронный донорно-акцепторный комплекс между этоксилированным нонилфенолом и ненасыщенной связью.
Правило Банкрофта и динамика адсорбции ПАВ:
Рис. 12 Поясняет правило Банкрофта, предсказывающее тип образующейся эмульсии в присутствии конкретного ПАВ. При наложении сдвиговых напряжений на смесь масла и воды межфазная граница масло-вода расширяется с образованием "пальцев" воды в масле и масла в воде. Такая ситуация неустойчива. Если происходит разрыв "пальцев" масла, образуется эмульсия типа "масло в воде"; если, наоборот, происходит разрыв "пальцев" воды, образуется эмульсия "вода в масле". Для стабилизации новых образующихся капель, независимо от типа возникающей структуры, требуется определенное время для диффузии эмульгатора к межфазной границе и его адсорбции на ней в количестве, необходимом для предотвращения быстрой коалесценции. В эксперименте, результаты которого легли в основу схемы на рис. 12, был использован маслорастворимый эмульгатор. Все последующее обсуждение основано на том, что адсорбция ПАВ на возникающей межфазной границе масло-вода происходит не мгновенно. "Пальцы" воды разрушаются, и сразу после этого реализуется ситуация, показанная на рис. 12, б. Адсорбция ПАВ не достигает равновесия: она больше в местах, где уже раньше существовала межфазная граница и ниже в пространстве между каплями, поскольку именно в этих местах образуется новая межфазная поверхность. Молекулы эмульгатора не имеют достаточного времени, чтобы достичь этих мест.
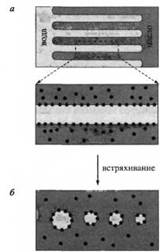
Рис. 12. Динамическая интерпретация правила Банкрофта: точки изображают молекулы эмульгатора
В результате создаются динамические градиенты межфазного натяжения, приводящие к перетеканию масла в зазоры между каплями за счет вязкостных сил - это пример проявления эффекта Марангони. Далее капли на какое-то время быстро расходятся, но этого времени достаточно для их стабилизации. Если бы происходил разрыв "пальцев" масла, то молекулы эмульгатора находились бы внутри капель и покрытие поверхности было бы одинаковым с самого начала. При этом не создавались бы условия для проявления эффекта Марангони, необходимого для разделения капель в течение критического начального периода эмульгирования.
Правило Банкрофта и геометрия молекулы поверхностно-активного вещества:
Существует еще один подход для объяснения правила Банкрофта: предполагается, что тип образующейся эмульсии определяется геометрией молекул ПАВ. Поверхностно-активные вещества с большим значением КПУ требуют больше пространства со стороны масла, и поэтому они преимущественно образуют эмульсии "вода в масле". У поверхностно-активных веществ с крупными полярными группами требования противоположные, поэтому они образуют эмульсии "масло в воде". Подобные идеи высказывались и ранее при попытках объяснить, почему некоторые ПАВ образуют эмульсии с неполярной дисперсионной средой, тогда как другие -- с водной. Однако при сравнении размеров капель в эмульсиях и молекул ПАВ становится понятно, что в масштабе молекул ПАВ межфазная граница масло-вода почти плоская, так что разница между двумя способами ориентации молекул ПАВ должна быть небольшой. Недавно подход на основе геометрии молекул получил дальнейшее развитие с другой точки зрения. Показано, что спонтанная кривизна межфазной границы контролирует скорости коалесценции эмульсий через величины соответствующих энергетических барьеров процесса коалесценции. При разрыве эмульсионной пленки образуются два сильно искривленных монослоя.
Со временем радиус кривизны значительно увеличивается, но в момент разрыва пленки возникают небольшие радиусы кривизны. В этот переходный момент ПАВ с высоким значением КПУ, например поверхностно-активные вещества с двумя гидрофобными радикалами, благоприятствуют образованию структур типа "вода в масле", и наоборот. Затраты энергии на искривление монослоя могут быть большими для таких сильно искривленных поверхностей. Ярким примером использования концепции кривизны для объяснения типа образующейся эмульсии являются системы масло-вода-ПАВ вблизи ТИФ, когда в качестве поверхностно-активного вещества используется оксиэтилированное НПАВ. Такие смеси образуют три фазы: микроэмульсию в равновесии с избытками масла и воды. Если после удалении микроэмульсионной фазы, содержащей почти все поверхностно-активное вещество, две остающиеся фазы перемешивать, может образоваться эмульсия. Тип образующейся эмульсии целиком зависит от того, проводится ли эмульгирование при температуре выше или ниже ТИФ данной системы. При температуре ниже ТИФ спонтанная кривизна микроэмульсии выпукла по отношению к воде, т. е. КПУ НПАВ немного меньше 1. В этих условиях образуется эмульсия "масло в воде". При температуре выше ТИФ кривизна выпукла по отношению к маслу и КПУ НПАВ немного больше 1, соответственно, образуется эмульсия типа "вода в масле". В этом случае, по-видимому, относительная растворимость НПАВ в масле и воде не играет никакой роли. Молекулярная растворимость нормальных алифатических этоксилированных спиртов, например С12Е5, в углеводородах на несколько порядков выше, чем в воде.
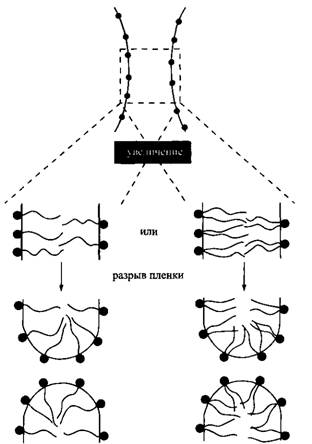
Рис. 13. Разрыв тонкой пленки масла в системе масло - вода - ПАВ приводит к образованию сильно искривленного монослоя. Геометрия молекул ПАВ с двумя углеводородными цепями не способствует стабилизации разорвавшейся пленки масла. Сравните с разрывом пенных пленок
При использовании очень небольших концентраций или малоэффективного поверхностно-активного вещества тип образующейся эмульсии контролируется скорее процессом смешения, а не выбором ПАВ. В таких системах правило Банкрофта может не выполняться. Например, добавление масла к раствору НПАВ в воде может приводить к образованию эмульсии "масло в воде" также и при температуре выше температуры инверсии фаз, если концентрация ПАВ очень низка. Эмульсии, образование которых лимитируется гидродинамикой, обычно малоустойчивы и не представляют интереса для практических целей.
ККМ (критическая концентрация мицеллообразования)
Определение ККМ может осуществляться при изучении практически любого свойства растворов в зависимости от изменения их концентрации. Наиболее часто в исследовательской практике используются зависимости мутности растворов, поверхностного натяжения, электрической проводимости, коэффициента преломления света и вязкости от общей концентрации растворов. Примеры получающихся зависимостей приведены на рис. 14.Критическую концентрацию мицеллообразования определяют по той точке, которая соответствует излому на кривых зависимостей свойств растворов от концентрации. Считается, что при концентрациях, меньших ККМ в растворах ПАВ, присутствуют лишь молекулы и зависимость любого свойства определяется именно концентрацией молекул. При образовании мицелл в растворах свойство будет претерпевать резкое изменение в связи со скачкообразным увеличением размера растворенных частиц. Так, например, молекулярные растворы ионогенных ПАВ проявляют электрические свойства, характерные для сильных электролитов, а мицеллярные - характерные для слабых электролитов. Это проявляется в том, что эквивалентная электрическая проводимость в растворах ионогенных ПАВ при концентрациях ниже ККМ в зависимости от корня квадратного из концентрации растворов оказывается линейной, что характерно для сильных электролитов, а после ККМ - зависимость ее оказывается типичной для слабых электролитов. Аналогичное изменение наблюдается и на зависимостях практически любого свойства растворов ПАВ от их концентрации. Водные растворы многих поверхностно-активных веществ обладают особыми свойствами, отличающими их как от истинных растворов низкомолекулярных веществ, так и от коллоидных систем. Одной из отличительных особенностей растворов ПАВ является возможность существования их как в виде молекулярно-истинных растворов, так и в виде мицеллярных - коллоидных.
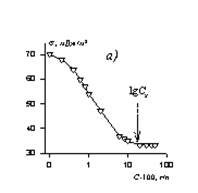




Рис. 14.Зависимость свойств растворов ПАВ от концентрации.
Свойство: а - поверхностное натяжение (s) растворов додецилсульфата натрия при 25оС ; б - эквивалентная электрическая проводимость (l) растворов децилтриметиламмоний бромида при 40о С ; в - удельная электрическая проводимость (k) растворов децилсульфата натрия при 40оС; г - вязкость (hотн/с) растворов додецилсульфата натрия при 30оС; д - мутность (t) растворов 6-оксиэтилированного октанола при 200С; е-коэффициент диффузии растворов оксидиметиддодециламина при 30оС(D).
Переход из молекулярного состояния в мицеллярное происходит, как правило, в достаточно узкой области концентраций, ограниченной, так называемыми, граничными концентрациями. Впервые наличие таких граничных концентраций обнаружил шведский ученый Экваль. Он установил, что при граничных концентрациях многие свойства растворов резко меняются. Эти граничные концентрации лежат ниже и выше средней ККМ; только при концентрациях, меньших минимальной граничной концентрации, растворы ПАВ аналогичны истинным растворам низкомолекулярных веществ. В принципе, исследование любого свойства растворов ПАВ от его концентрации позволяет определить среднюю концентрацию, при которой система совершает переход в коллоидное состояние. К настоящему моменту описано более сотни разнообразных методов определения критической концентрации мицеллообразования; некоторые из них, кроме ККМ, позволяют также получать богатую информацию о структуре растворов, величине и форме мицелл, их гидратации и т. д. Мы остановимся только на тех методах определения ККМ, которые используются наиболее часто. Для определения ККМ по изменению поверхностного натяжения растворов ПАВ часто используются методы максимального давления в газовом пузырьке, сталагмометра, отрыва кольца или уравновешивания пластины, измерения объема или формы висящей или лежащей капли, взвешивания капель и др. Определение ККМ этими методами основано на прекращении изменения поверхностного натяжения раствора при предельном насыщении адсорбционного слоя на поверхности раздела "вода - воздух", "углеводород - вода", "раствор - твердая фаза".Наряду с определением ККМ эти методы позволяют найти величину предельной адсорбции, поверхностную активность, минимальную площадь, приходящуюся на молекулу в адсорбционном слое. На основании экспериментальных значений поверхностной активности на границе "раствор-воздух" и предельных площадей, приходящихся на молекулу в насыщенном адсорбционном слое, может быть определена также длина полиоксиэтиленовой цепи неионогенных ПАВ и величина углеводородного радикала. Определение ККМ при различных температурах часто используют для расчета термодинамических функций мицеллообразования. Исследования показывают, что наиболее точные результаты получаются при измерении поверхностного натяжения растворов ПАВ методом уравновешивания пластины. Достаточно хорошо воспроизводятся результаты, найденные сталогмометрическим методом. Менее точные, но достаточно корректные данные получаются при использовании метода отрыва кольца. Плохо воспроизводятся результаты чисто динамических методов. При определении ККМ вискозиметричесим методом экспериментальные данные выражают обычно в виде зависимости приведенной вязкости от концентрации растворов ПАВ. Вискозиметрический метод также позволяет определить наличие граничных концентраций мицеллообразования и гидратацию мицелл по характеристической вязкости. Этот метод особенно удобен для неионогенных ПАВ в связи с тем, что у них отсутствует электровязкостный эффект. Определение ККМ по светорассеянию основано на том, что при образовании мицелл в растворах ПАВ резко возрастает рассеяние света частицами и увеличивается мутность системы. По резкому изменению мутности раствора и определяют ККМ. При измерении оптической плотности или светорассеяния растворов ПАВ часто наблюдают аномальное изменение мутности, особенно в том случае, если ПАВ содержит некоторое количество примесей. Данные светорассеяния используют для определения мицеллярной массы, чисел агрегации мицелл и их формы. Определение ККМ по диффузии проводят измеряя коэффициенты диффузии, которые связаны как с размером мицелл в растворах, так и с их формой и гидратацией. Обычно значение ККМ определяют по пересечению двух линейных участков зависимости коэффициента диффузии от разведения растворов. Определение коэффициента диффузии позволяет рассчитать гидратацию мицелл или их размер. Совмещая данные измерения коэффициента диффузии и коэффициента седиментации в ультрацентрифуге, можно определить мицеллярную массу. Если измерить гидратацию мицелл независимым методом, то по коэффициенту диффузии можно определить форму мицелл. Наблюдение за диффузией проводится обычно при введении в растворы ПАВ дополнительного компонента - метки мицелл, поэтому метод может дать искаженные результаты при определении ККМ, если произойдет смещение мицеллярного равновесия. В последнее время коэффициент диффузии измеряют при использовании радиоактивных меток на молекулах ПАВ. Такой способ не смещает мицеллярного равновесия и дает наиболее точные результаты. Определение ККМ рефрактометрическим методом основано на изменении коэффициента преломления растворов ПАВ при мицеллообразовании. Этот метод удобен тем, что не требует введения дополнительных компонентов или применения сильного внешнего поля, которые могут сместить равновесие "мицеллы-молекулы", и оценивает свойства системы практически в статических условиях. Он требует, однако, тщательного термостатирования и точного определения концентрации растворов, а также необходимости учета времени эксперимента в связи с изменением коэффициента преломления стекла за счет адсорбции ПАВ. Метод дает хорошие результаты для неионогенных ПАВ с невысокой степенью оксиэтилирования. В основе определения ККМ ультраакустическим методом лежит изменение характера прохождения ультразвука через раствор при образовании мицелл. При изучении ионогенных ПАВ этот метод удобен даже для весьма разбавленных растворов. Растворы неионогенных веществ труднее поддаются характеристике этим методом, особенно если растворенное вещество имеет малую степень оксиэтилирования. С помощью ультраакустического метода можно определить гидратацию молекул ПАВ как в мицеллах, так и в разбавленных растворах. Широко распространенный кондуктометрический метод ограничен только растворами ионогенных веществ. Кроме ККМ он позволяет определить степень диссоциации молекул ПАВ в мицеллах, что необходимо знать для корректировки мицеллярных масс, найденных по светорассеянию, а также для введения поправки на электровязкостный эффект при расчете гидратации и чисел ассоциации методами, связанными с явлениями переноса. Иногда используются такие методы, как ядерный магнитный резонанс или электронный парамагнитный резонанс, которые дают возможность кроме ККМ измерять "время жизни" молекул в мицеллах, а также как ультрафиолетовая и инфракрасная спектроскопия, которые позволяют выявить расположение молекул солюбилизата в мицеллах. Полярографические исследования, так же как и измерения рН растворов, часто связаны с необходимостью введения третьего компонента в систему, что, естественно, искажает результаты определения ККМ. Методы солюбилизации красителя, солюбилизационного титрования и хроматографии на бумаге, к сожалению оказываются недостаточно точными для измерения ККМ, но зато позволяют судить о структурных изменениях мицелл в относительно концентрированных растворах.
Число агрегации мицелл
Образование агрегатов - мицелл - начинается при определенной концентрации, индивидуальной для каждого ПАВ. Эта концентрация, точнее узкая область концентраций, при которой образуются мицеллы, называется критической концентрацией мицеллообразования (ККМ). Значение ККМ "размыто" по шкале концентраций, т. к. мицеллообразование - это не образование новой макроскопической фазы и не может характеризоваться единственной критической точкой перехода. Ниже представлен фрагмент типичной фазовой диаграммы температура - состав для системы ПАВ - вода. На ней видна кривая растворимости ПАВ. Это кривая сосуществования кристаллического (чистого или сольватированного) ПАВ и его раствора. Температура (фактически узкая температурная область), соответствующая месту изгиба, называется точкой Крафта.
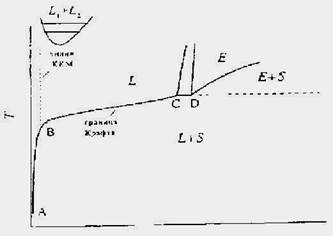
Рис.15. Фрагмент фазовой диаграммы температура (Т) - состав для системы ПАВ - вода; Х1 - мольная доля ПАВ; L, E,S - означают соответственно изотропный раствор, жидкокристаллическую и твердую фазы; L1+ L2 - область сосуществования двух жидких фаз.
Как видно из диаграммы, при низких температурах и концентрациях раствор не образует мицелл. Область изотропного мицеллярного раствора ограничена слева линией ККМ, а снизу кривой растворимости (кристаллизации). Эта граница называется также границей Крафта. Она имеет очень большое значение в практическом применении, т. к. это нижняя температурная граница существования жидкого мицеллярного раствора. При более высоких температурах может наблюдаться область сосуществование двух жидких фаз, в случае если при этих температурах одно из веществ не разложится или не произойдет фазового перехода. Температура, выше которой наблюдается расслаивание двух фаз, называется точкой помутнения. Ее существование характерно для неионогенных ПАВ. Выше кривой растворимости последовательно при увеличении концентрации наблюдается изотропный мицеллярный раствор (L), узкая область сосуществования изотропного раствора и жидкокристаллической фазы, область существования жидких кристаллов (Е), твердые фазы. Область жидкого мицеллярного раствора L не однородна. С увеличением концентрации ПАВ размеры и форма мицелл меняются, что отражается на важных для практики свойствах раствора. При ККМ образуются сферические мицеллы. Согласно Хартли, они представляют собой коллоидные частицы, углеводородное ядро которых окружено полярными головками. С увеличением концентрации числа агрегации мицелл растут слабо, но сильно зависят от добавок солей. Дальнейшие исследования показали, что углеводородное ядро является подобием жидкого парафина, но, в отличие от модели Хартли, имеет некоторую упорядоченность строения. Числа агрегации мицелл зависят от природы ПАВ, от числа углеводородных атомов в цепи, ионной силы раствора и т. д. Так, число агрегации СТАВ в 0,013н. водном растворе KBr равно 169, а число агрегации додецилсульфата натрия в водном растворе 62. Мицеллы имеют слоистую структуру: внутренняя часть - углеводородное ядро, следующий слой - толщиной 1-2 атома углеводорода, ближайших к полярной группе - содержит молекулы воды, поэтому отличается от углеводородного ядра. Следующий слой - гидратированные полярные группы, которые можно представить как слой Штерна. Далее внемицеллярный слой Гуи-Чепмена. Поверхность мицеллы не является гладкой, часть молекул ПАВ расположена дальше от центра мицеллы, чем остальные. При расчетах необходимо учитывать увеличение площади поверхности мицеллы за счет неоднородности ее поверхности. Тэнфорд при расчетах увеличивал площадь на 10%. При концентрации выше ККМ в растворе молекулы ПАВ находятся в равновесии с мицеллами. Дальнейшее увеличение концентрации приводит к росту количества и размеров мицелл. Таким образом, агрегаты становятся емкими поглотителями мономеров, и концентрационные зависимости многих свойств раствора от концентрации имеют излом при концентрациях равных ККМ, благодаря чему становится возможным ее определение. При дальнейшем увеличении концентрации ПАВ в растворе могут образоваться более сложные агрегаты. Это могут быть цилиндрические, дискообразные, эллипсообразные мицеллы (см. рис.16).
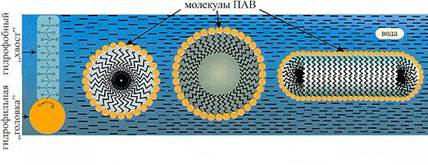
Рис. 16. Строение мицелл ионного ПАВ в воде.
Поверхностная активность детергентов, то есть способность адсорбироваться на границе раздела фаз (типа вода-воздух или вода-масло), связана с амфифильностью их молекул. Амфифильными (от греч. фило - любящий и амфи - обоих) называют вещества, в молекулах которых имеются четко разграниченные гидрофильные и гидрофобные области, благодаря чему такие молекулы обладают сродством не только по отношению к воде, но и к неполярным органическим растворителям. В воде молекулы детергентов стремятся ассоциировать друг с другом, давая мицеллы. Эти агрегаты состоят из большого числа детергентных молекул (обычно от нескольких десятков до нескольких сот), ориентированных в мицелле таким образом, что их неполярные группы формируют внутреннее гидрофобное ядро мицеллы, а гидрофильные полярные группировки находятся на ее поверхности и контактируют с окружающими молекулами воды. Именно благодаря наличию гидрофобного ядра мицеллы способны солюбилизировать, то есть переводить в раствор неполярные вещества, практически нерастворимые в воде. В настоящее время известно несколько сот различных детергентов. Все они разделяются на два основных класса: ионные и неионные детергенты в зависимости от наличия или отсутствия заряженных групп в гидрофильной области их молекул. В свою очередь, по типу заряда ионные детергенты делятся на катионные, имеющие положительный заряд, анионные, обладающие отрицательным зарядом, и цвиттер-ионные, у которых имеется как положительный, так и отрицательный заряд, и поэтому в целом молекула является электрически нейтральной. В качестве параметров, характеризующих способность детергентов к мицеллообразованию, обычно используют критическую концентрацию мицеллообразования (ККМ) и число агрегации. ККМ - это та концентрация, при которой детергент начинает образовывать мицеллы. До этого он находится в воде в мономерной форме в состоянии истинного раствора. Число агрегации показывает, сколько молекул детергента приходится на одну мицеллу. В мембранных исследованиях используют довольно ограниченный круг детергентов. Для этих детергентов характерны довольно высокие значения ККМ (10- 4-10- 2 М) и то, что они относятся к разряду так называемых мягких детергентов, то есть таких, которые не нарушают активности мембранных белков и не вызывают их денатурации или делают это в минимальной степени. Вообще говоря, выбор детергента для реконструкции мембраны, как правило, представляет сложную задачу, поскольку заранее трудно предсказать, насколько удачным окажется данный детергент для данной конкретной мембраны и для данного конкретного белка. Кроме того, нередко требования к детергенту, используемому для солюбилизации мембраны, отличаются от требований, предъявляемых к детергенту при реконструкции. Поэтому иногда приходится в ходе эксперимента заменять один детергент на другой или использовать смеси разных детергентов. Почему и как детергенты разрушают мембрану Большая часть тех веществ, из которых построены биологические мембраны, а это главным образом белки и липиды, практически нерастворимы в воде. С помощью этих методов многие белки были выделены в индивидуальном состоянии, что позволило установить их химическое строение и выяснить молекулярные механизмы функционирования. Реконструированные системы дают прекрасную возможность изучать принципы, лежащие в основе структурной организации биологических мембран, и выяснять тонкие детали межмолекулярных взаимодействий в мембранах с помощью различных физико-химических методов. Методами реконструкции удается воспроизводить сложнейшие системы, ответственные за такие жизненно важные функции, как, например, энергетическое обеспечение клетки, транспорт метаболитов, рецепция и передача информации, а также регуляция внутриклеточных процессов. И наконец, знание принципов самосборки молекул в мембранные структуры дает нам, с одной стороны, возможность понять, как формируются мембраны внутри клетки, а с другой - позволяет применить эти принципы для построения искусственных систем, перспективных с точки зрения возможностей их практического применения. Именно в этом направлении идет сегодня дальнейшее развитие исследований в области реконструкции мембран.
Оптические свойства коллоидных растворов:
Особые оптические свойства коллоидных растворов обусловлены их главными особенностями: дисперсностью и гетерогенностью. На оптические свойства дисперсных систем в значительной степени влияют размер и форма частиц. Прохождение света через коллоидный раствор сопровождается такими явлениями, как поглощение, отражение, преломление и рассеяние света. Преобладание какого-либо из этих явлений определяется соотношением между размером частиц дисперсной фазы и длиной волны падающего света. В грубодисперсных системах в основном наблюдается отражение света от поверхности частиц. В коллоидных растворах размеры частиц сравнимы с длиной волны видимого света, что предопределяет рассеяние света за счет дифракции световых волн. Светорассеяние в коллоидных растворах проявляется в виде опалесценции - матового свечения (обычно голубоватых оттенков), которое хорошо заметно на темном фоне при боковом освещении золя. Причиной опалесценции является рассеяние света на коллоидных частицах за счет дифракции. С опалесценцией связано характерное для коллоидных систем явление - эффект Тиндаля: при пропускании пучка света через коллоидный раствор с направлений, перпендикулярных лучу, наблюдается образование в растворе светящегося конуса. Процесс дифракционного светорассеяния на частицах, размер которых значительно меньше длины волны описывается уравнением Рэлея, связывающим интенсивность рассеянного единицей объема света I с числом частиц в единице объема н, объемом частицы V, длиной волны л и амплитудой А падающего излучения и показателями преломления дисперсной фазы и дисперсионной среды n1 и n2 соответственно:

Из уравнения видно, что, чем меньше длина волны падающего излучения, тем больше будет рассеяние. Следовательно, если на частицу падает белый свет, наибольшее рассеивание рассеяние будут испытывать синие и фиолетовые компоненты. Поэтому в проходящем свете коллоидный раствор будет окрашен в красноватый цвет, а в боковом, отраженном - в голубой. На сравнении интенсивности светорассеяния золей, один из которых имеет известную концентрацию (степень дисперсности), основан метод определения концентрации либо степени дисперсности золя, называемый нефелометрией. На использовании эффекта Тиндаля основывается ультрамикроскоп - прибор, позволяющий наблюдать коллоидные частицы размером более 3 нанометров в рассеянном свете (в обычном микроскопе можно наблюдать частицы с радиусом не менее 200 нм из-за ограничений, связанных с разрешающей способностью оптики).
Рассеяние света. Уравнение Рэлея. Рассеянный свет характеризуется следующими особенностями:
- 1) При опалесценции не происходит изменения длины волны; такое рассеяние называют "упругим". Поэтому при освещении золя монохроматическим светом опалесцирующая система имеет тот же цвет, что и падающий луч. Этим данное явление отличается от явлений люминесценции, например, флуоресценции. (Флуоресценция, наблюдаемая в растворах некоторых веществ, представляет собой внутримолекулярный процесс, состоящий в том, что молекулы флуоресцирующего вещества селективно поглощают свет определенной длины волны и трансформируют его в световые лучи с большей длиной волны.) 2) Интенсивность светорассеяния неодинакова по различным направлениям. Наибольшая доля рассеянного света отвечает направлениям 0о и 180о относительно направления падающего света. 3) Рассеянный свет частично поляризован, причем доля поляризованного света также зависит от направления.
Угловое распределение рассеянного света наглядно представляет векторная диаграмма (рис.17).
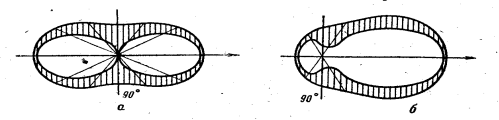
Рис. 17.Угловое распределение света, рассеянного малой (а) и крупной (б) сферическими частицами. Заштрихована область поляризованного рассеянного света.
На ней интенсивность неполяризованного и поляризованного (заштриховано) рассеянного света представлена радиусами-векторами соответствующей длины и направления. Сплошная линия, соединяющая концы векторов - индикатриса светорассеяния. Для очень малых частиц (d << л) индикатриса симметрична, наибольшее суммарное светорассеяние наблюдается в прямом и обратном направлениях относительно падающего луча, при этом поляризации не наблюдается. Под углом 90о рассеянный свет полностью поляризован. При увеличении размера частиц (d > л) увеличивается доля света, рассеивающегося в "прямом " направлении (индикатриса "вытягивается вперед", в направлении падающего луча). Теория светорассеяния частицами, малыми в сравнении с длиной волны, развита Рэлеем. Он вывел уравнение светорассеяния для сферических непроводящих частиц (диэлектриков), концентрация которых достаточно мала, так что отсутствует вторичное рассеяние (когда свет, рассеянный одной частицей рассеивается на соседней частице). При выполнении всех этих условий суммарная интенсивность света Iр, рассеянного по всем в пространстве единицей объема рассевающей среды, равна:

(1)
Где n и n0 - показатели преломления дисперсной фазы и дисперсионной среды;
Н - численная концентрация (число частиц в 1 см3 коллоидной системы);
V - объем одной частицы;
Л - длина волны монохроматического света в данной среде.
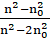
В этом уравнении величина k =243 ()2 - оптическая константа данной системы. Она характеризует различие оптических свойств дисперсной фазы и дисперсионной среды. Отношение р 0/ I (коэффициент рассеяния) представляет собой физическую величину, которая характеризует рассевающую способность системы и называется мутностью (ф):

Ф=/; (2)

Мутность численно равна интенсивности света, рассеиваемого единицей объема системы по всем направлениям в пространстве при интенсивности падающего света, равной единице. Если объем сферической частицы выразить через радиус r, т. е. как V = 4рr3/3 , а численную концентрацию н через весовую с (в г/см3) по формуле :
Н = с/(Vс ) (3)
Где с - плотность дисперсной фазы.
Из уравнения Рэлея можно сделать следующие выводы:
- 1. Для частиц данного размера мутность золя прямо пропорциональна его концентрации. Это положение используется для определения концентрации дисперсной фазы с помощью измерения светорассеяния золя. 2. При данной концентрации дисперсной фазы мутность очень резко возрастает с увеличением размера частиц (пропорциональна кубу их радиуса). Линейная зависимость ф r3 сохраняется лишь в сравнительно узкой области размеров, пока частицы значительно меньше длины волны света. Далее с увеличением размера частиц рост величины ф замедляется, и для частиц с размером, превышающим л, светорассеяние переходит в отражение света и по мере увеличения частиц интенсивность рассеянного света уменьшается. Таким образом, зависимость ф r3 проходит через максимум, что подтверждается опытом.


3. Интенсивность светорассеяния резко возрастает с уменьшением длины волны падающего света. Поскольку ф 1/4 , то при освещении бесцветного золя, белым светом рассеиваются, главным образом, короткие волны (сине-фиолетовая часть спектра), так что при наблюдении сбоку такой золь имеет синеватую окраску. В проходящем свете золь имеет красновато-оранжевый оттенок, т. к. спектр проходящего света обогащен длинноволновыми лучами. Преимущественное рассеяние света с малой длиной волны объясняет ряд природных оптических явлений. Причина голубого цвета неба днем в том, что наблюдатель видит свет, рассеянный в атмосфере Земли, а утром и вечером оранжевый или красный цвет неба обусловлен тем, что наблюдается главным образом свет, прошедший через атмосферу. На зависимости светорассеяния от длины световой волны основано также применение синего света для светомаскировки (он сильно рассеивается в толще воздуха и незаметен с самолета), а красного и оранжевого - для сигнализации (противотуманные фары). Уравнение Рэлея широко используется для определения размера коллоидных частиц по измерениям мутности. Следует иметь в виду, что область его применимости ограничивается условиями "рэлеевского" рассеяния, когда размер частиц не превышает 1/5 - 1/10 длины волны падающего света. Для частиц большего размера интенсивность рассеянного света изменяется обратно пропорционально не четвертой, а меньшей степени длины волны: d=Ip1/n, где n4. Для непроводящих сферических частиц с увеличением размера до d величина n уменьшается в пределе до 2. Геллер предложил выразить мутность формулой: ф=k, где k - константа, не зависящая от длины волны. При n = 4 выражение соответствует уравнению Рэлея. В логарифмической форме имеем: lgф = const-nlg. Зависимость lg ф от lg л - представляет собой прямую, отрицательный тангенс угла наклона которой равен показателю степени n. Теория светорассеяния частицами, не подчиняющимися уравнению Рэлея (Шифрин) устанавливает связь величины n c параметром (z), выражающим соотношение между размером частиц и длиной волны падающего света:

Z=8 (4)
Значения z для различных n рассчитаны и табулированы, что дает возможность расчета r по экспериментально найденному значению n. (Для расчета по формуле используется среднее значение л в том интервале, в котором проводилось определение n).Описанный метод пригоден при размерах частиц до1/3), что заметно расширяет диапазон измеряемых величин r.

Похожие статьи
-
Неионогенные ПАВ - Коллоидные поверхностно-активные вещества
Неионогенные ПАВ - высокомолекулярные соединения, не образующие ионов в водном растворе. Их растворимость обусловлена наличием в молекулах гидрофильных...
-
Введение - Коллоидные поверхностно-активные вещества
Поверхностно-активные вещества (ПАВ) -- химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного...
-
ПАВ и ПИВ - Коллоидные поверхностно-активные вещества
Одним из основных свойств поверхностно-активных веществ является их способность адсорбироваться из объема жидкости, где они растворены, на поверхности...
-
1) рассеяние света 2) флотация-всплывание каллоидных частиц на поверхность 3) сидиментация - выпадение в осадок коллоидных частиц 4)коагуляция-уменьшение...
-
Диспергированием называют тонкое измельчение твердых мате-риалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате...
-
Специфические способы определения удельной свободной поверхностной энергии - Коллоидная химия
Поверхностная энергия , энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме. При увеличении поверхности раздела...
-
Адсорбция на границе жидкость - газ Сорбцией (от лат. "sorbeo" - поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорбтива) другим...
-
Формулы катионактивных ПАВ. - Коллоидные поверхностно-активные вещества
Катионактивные ПАВ меньше снижают поверхностное натяжение, чем анионактивные, но они могут взаимодействовать химически с поверхностью адсорбента,...
-
Катионактивные ПАВ - Коллоидные поверхностно-активные вещества
Катионактивными называют ПАВ, молекулы которых диссоциируют в водном растворе с образованием поверхностно-активного катиона с длинной гидрофобной цепью и...
-
КОЛЛОИДНЫЕ ВЕЩЕСТВА ПРИРОДНЫХ ВОД И ИХ УДАЛЕНИЕ - Химические свойства и строение воды
Очистка сточных вод -- лишь одно из направлений защиты гидросферы, прежде всего, поверхностных вод от антропогенных загрязнений. Главный путь защиты...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Применение коллоидных систем в повседневной жизни
I тип - суспензоиды (или необратимые коллоиды, лиофобные коллоиды). Коллоидные растворы металлов, их оксидов, гидроксидов, солей. Первичные частицы...
-
Способы получения коллоидных систем - Общая характеристика дисперсных систем и методы их получения
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами и грубодисперсными системами. Поэтому коллоидные...
-
Конденсационные методы получения коллоидных систем - Методы очистки и получения коллоидных растворов
Из классификации дисперсных систем по размеру частиц следует, что коллоидные растворы (золи) занимают промежуточное положе-ние между молекулярными и...
-
МИКРОГЕТЕРОГЕННЫЕ СИСТЕМЫ. ЭМУЛЬСИИ - Микрогетерогенные системы. Суспензии и пасты
Эмульсии - системы образованные смешиванием двух взаимонерастворимых жидкостей, т. е. это лиофобные дисперсные системы с жидкой дисперсионной средой и...
-
Органические и неорганические соединения нефти имеют различную растворимость в воде, органических соединениях и по отношению друг к другу. Подавляющая...
-
Тепловые эффекты при растворении. Механизмы растворения веществ в воде - Растворы
Растворение веществ сопровождается различными тепловыми эффектами в зависимости от природы вещества. При растворении в воде, например, гидроксида калия...
-
Процессы окисления. - Методы очистки и получения коллоидных растворов
Наряду с серой в реакциях окисления обычно образуются политио-новые кислоты, главным образом пентатионовая кислота H2S5O6 Реакции двойного обмена....
-
Особенности структуры аморфных наночастиц - Коллоидная химия
По геометрическому признаку (мерности дисперсных частиц) наносистемы можно разделить на три группы. 1. Трехмерные (объемные) наночастицы , у которых все...
-
Воздушная известь - одно из древнейших вяжущих, широко применяемых в строительстве и промышленности. Известь - продукт умеренного обжига кальциевых и...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
Измерение низких температур - Свойства веществ при низких температурах
Первичным термометрическим прибором для измерения термодинамической температуры вплоть до 1 К служит Газовый термометр . Др. вариантами первичного...
-
- кориандр, - анис, - фенхель, тмин, - укроп; Травянистое (листья, надземная часть травянистых растений, молодые ветви древесных растений): - мята, -...
-
Пектиновые вещества -- это высокомолекулярные углеводы растительного происхождения, главным структурным компонентом которых является D-галактуроновая...
-
Физические и химические свойства простого вещества - Свойства германия
Начать следует с описания физических свойств простого вещества германия. Германий представляет собой твердый серебристо-белый полуметалл, обладающий...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Влияние различных факторов на растворимость веществ - Растворы
Растворимость зависит от природы растворяемого вещества и растворителя, температуры, давления и влияния посторонних веществ. Природа веществ, образующих...
-
Класс алкилбензолов представлен 37 соединениями в табл.3, где приведены экспериментальные данные, использованные нами при определении значений параметров...
-
Поверхностный натяжение адсорбция адгезия Поверхностное натяжение различных конденсированных тел на границе с газом непосредственно связано с межатомным...
-
Алкильная составляющая с тем или иным весом входит в состав молекулы большинства органических соединений, по этой причине качество прогнозирования...
-
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме...
-
Способы очистки коллоидных систем - Общая характеристика дисперсных систем и методы их получения
Некоторые молекулярно-кинетические свойства коллоидных систем используют для очистки золей от электролитов и молекулярных примесей, которыми полученные...
-
Растворимость веществ - Растворы
Растворение - самопроизвольный (так как идет с увеличением энтропии в системе) обратимый процесс. Однако растворение возможно только до определенного...
-
Изолирование пестицидов из биологических материалов наиболее часто осуществляется экстракцией различными органическими растворителями: пентан, н-гексан,...
-
Физика низких температур, Низкие температуры - Свойства веществ при низких температурах
Низкие температуры Низкие температуры, криогенные температуры, обычно температуры, лежащие ниже точки кипения жидкого воздуха (около 80 К). Такие...
-
Важнейшей характеристикой раствора является его состав. Содержание растворенного вещества в растворе может быть выражено безразмерными единицами (долями...
-
Адсорбция Лэгмюра и Фрейндлиха
Адсорбция. Изотермы адсорбции Лэгмюра, Фрейндлиха. Уравнение БЭТ и его анализ Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается...
-
Классификация дисперсных систем - Общая характеристика дисперсных систем и методы их получения
Рассматривается классификация именно дисперсных систем, т. к. коллоидные растворы являются видом дисперсных систем. Следует отметить, что коллоидная...
-
В технике в большинстве случаев инженер имеет дело с дисперсными системами, которые состоят из дисперсной фазы и дисперсионной среды. Дисперсная фаза -...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
Концепция гидрофильно-липофильного баланса - Коллоидные поверхностно-активные вещества