Оптическая геометрия нефелометров - Коллоидные поверхностно-активные вещества
Третий компонент, влияющий на качество показаний нефелометров - это оптическая геометрия, которая включает в себя параметры конструкции прибора, такие как, например, угол детектирования рассеянного света. Как пояснялось в разделе, посвященном теории рассеяния, различия в строении частиц вызывает различную угловую интенсивность рассеяния. Почти все нефелометры, используемые в анализе воды и стоков, имеют угол анализа равный 90°. Кроме того, что такой угол обеспечивает меньшую чувствительность к изменению размера частиц, прямой угол дает простую оптическую систему с малым количеством постороннего света. Конструктивным параметром, определяющим, как чувствительность, так и линейность прибора, является длина оптического пути. С ростом оптического пути растет чувствительность, но в ущерб линейности показаний из-за множественного рассеяния и поглощения. И наоборот, с уменьшением длины оптического пути растет линейность, но падает чувствительность прибора в области низких концентраций (проблему можно решить, применив изменяемую длину оптического пути). Короткий оптический путь также увеличивает воздействие постороннего света. USEPA и ИСО требуют, чтобы длина оптического пути не превышала 10 см (от нити накала до детектора). Производимые HACH турбидиметры ratio™ для достижения максимальной стабильности используют комбинацию оптических устройств: детектор, расположенный под углом 90°, комбинацию детекторов проходящего света, прямого и обратного рассеяния и зеркала, отражающие только ИК излучение. Дополнительная информация представлена в разделе данной статьи, посвященном турбидиметрам ratio™.
Растворы ВМС - являются истинными растворами, а это значит, что они представляют собой гомогенные системы, в которых взвешенные частицы не содержат ядер. Здесь, взвешенные частицы представлены макромолекулами - молекулами гигантских размеров. Таким образом, макромолекулы являются ответственными за большинство физических свойств растворов ВМС, которые сильно отличаются от свойств низкомолекулярных соединений. Строение микромолекул, в свою очередь, также оказывает сильное влияние на поведение растворов ВМС. Одной из главных особенностей ВМС является, так называемый процесс денатурации - специфическое необратимое осаждение белков. Он происходит при действии высококонцентрированных кислот и щелочей, дубильных веществ, под влиянием высокой и низкой температур, механического воздействия высокого давления, ультразвука, лучистой энергии. К основным высокомолекулярным соединениям относятся белки, целлюлоза, нитроцеллюлоза, каучук, желатин и др. Растворы ВМС - всегда термодинамически устойчивые системы, способные существовать без стабилизатора неограниченное время в весьма больших массовых и значительных молярных концентрациях. Они образуются самопроизвольно, с уменьшением свободной энергии. Если в качестве дисперсионной среды использовать такую жидкость, по отношению к которой данное высокомолекулярное вещество является лиофобным (не способным в нем раствориться), ВМС способны образовывать не только растворы, но и типичные лиофобные золи. В то же время растворы ВМС представляют собой равновесные системы, к которым применимо правило фаз, в отличие от лиофобных коллоидов. Растворы ВМС, так же, как растворы низкомолекулярных соединений, могут быть как молекулярными, так и ионными. В ионных растворах ВМС природа зарядов связана с наличием функциональных групп.
Явление светорассеяния и спектры поглощения ВМС:
В исследовании твердых полимеров важную роль играют инфракрасные спектры поглощения ВМС. К сожалению, они очень сложны для использования при исследовании самих растворов ВМС. Кроме того растворы ВМС характеризуются светорассеянием. Это свойство, изменение величины рассеяния света, чрезвычайно полезно для различных научных исследований. В частности, используется в методе определения относительной массы полимеров, т. к. цепные молекулы полимеров нельзя обнаружить в растворах при ультрамикроскопических наблюдениях. Метод основан на измерении мутности разбавленных растворов ВМС. Опалесцировать может любая жидкость - оптически пустых жидкостей не существует. Классическая термодинамика рассматривает равновесное состояние газообразной или жидкой системы как такое состояние, при котором плотность во всем объеме имеет одну и ту же постоянную величину. Если признать общность этого положения, то нельзя объяснить существование опалесцирования в индивидуальных жидкостях в рамках теории Рэлея, которая требует неравномерности распределения показателей преломления, а, значит, и плотностей во всем объеме. Современная статистическая термодинамика устраняет эти затруднения: она признает, что равномерное распределение плотности во всем объеме системы, находящейся в равновесном состоянии, является наиболее вероятным, но не единственно возможным. Что касается газов, то классическим примером их опалесценции является голубой цвет неба. Чем больше местные отклонения от средней частичной концентрации (так называемой флуктуации), тем ярче опалесценция. На основании теории флуктуации, созданной М. Смолуховским, П. Дебай вывел уравнение, позволяющее определить молекулярную массу растворенного полимерного вещества (ВМС):

(1)

(2)
Где ф =l/l0 (мутность). (3)
I, I0 - интенсивность падающего и рассеянного света;
H - оптическая постоянная;
N0 - коэффициент преломления света в растворителе;
Dn/dc - инкремент изменения коэффициента преломления света в растворе; NA - число Авогадро.
Молекулярная масса находится как:

(4)
Уравнение Дебая
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
H2SO4 > H++HSO4- ,а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов. Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
- 1)Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (с = 0,01 моль-л-1). 2)Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Очевидно, что при электростатическом взаимодействии ионов противоположных знаков необходимо учитывать влияние ионной атмосферы. При движении катиона в электростатическом поле ионная атмосфера деформируется; она сгущается перед ним и разрежается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящее действие движению катиона, чем выше концентрация электролитов и чем больше заряд ионов. В этих системах само понятие концентрации становится неоднозначным и должно заменяться активностью. Для бинарного одно-однозарядного электролита KatAn > Kat+ + An+ активности катиона (a+) и аниона (a-) соответственно равны
Где C+ и C - - аналитические концентрации соответственно катиона и аниона, г+ и г - - их коэффициенты активности. Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значений активностей и коэффициентов активностей:


Коэффициент активности по Дебаю-Хюккелю зависит по крайней мере от температуры, диэлектрической проницаемости растворителя (е) и ионной силы (I); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Для данного электролита ионная сила выражается уравнением Дебая-Хюккеля:
(1)
Ионная сила в свою очередь равна:

(2)
Здесь C - аналитическая концентрация;
Z - заряд катиона или аниона.
Для одно-однозарядного электролита ионная сила совпадает с концентрацией. Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будут иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита. На (рис.25.) сопоставляются вычисленные и экспериментальные значения lg г± при различных ионных силах. Из него видно, что уравнение Дебая-Хюккеля выполняется только для разбавленных растворов.
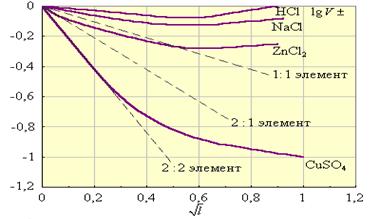

Рис. 25.Зависимость lg г±().
Пунктирные прямые рассчитаны по уравнению Дебая-Хюккеля. Знание коэффициентов активностей позволяет оценить реальные свойства сильных электролитов.
Уравнение Геллера:
Если радиус частиц больше l /20, то светорассеяние в таком золе не подчиняется уравнению Рэлея. Это выражается в том, что показатель степени при длине волны падающего света будет отличаться от 4, тогда используют эмпирическое уравнение Геллера:

(1)
Где Dл - оптическая плотность;
Л-длина волны падающего света;
Б-коэффициент, величина которого меняется от 1 до 4 в соответствии с диаметром частиц;
К - постоянная.
Эта зависимость имеет большое практическое значение, так как позволяет по экспериментально определенным величинам dл при нескольких значениях л, определить размеры частиц золя. Для этого достаточно построить прямую в координатах IgDл - lgл; тангенс угла наклона прямой равен коэффициенту б, {это легко показать, прологарифмировав основное уравнение: IgDл = lgK--бlgл). Далее по калибровочной кривой Геллера для латексов, построенной в координатах б - Z, и находят средний диаметр частиц исследуемой системы. Показатель б можно определить также по методу Теорелла: пользуясь всего двумя светофильтрами, получают два значения d для двух длин волн (желательно, чтобы различие в величинах л, было возможно большим); затем, пользуясь соотношением:

(2)
В 1946 г. Геллер установил зависимость показателя степени для белых золей от размера частиц, экспериментально определяемого независимым методом. Калибровочная кривая Геллера, которая может быть использована для графического определения радиуса частиц, приведена на рис. 26.
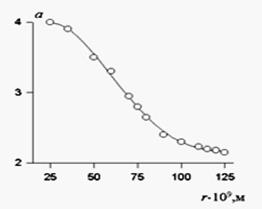
Рис.26. Зависимость показателя степени при длине волны света в уравнении от размера (радиуса) частиц в белых золях.
Для радиуса частиц от 50 до 100 нм калибровочная зависимость имеет линейный вид и может быть описана уравнением:
A = 3,1 - 2,16Ч10-2(r -50).
Это уравнение справедливо для а = 3,1е2,0. Для других значений показателя степени а расчет надо проводить с использованием функции Z. Для подавляющего большинства латексов синтетических полимеров радиус частиц более 25 нм, поэтому уравнение Рэлея не может быть использовано. Размер частиц таких латексов можно определить с помощью метода Геллера по результатам определения показателя степени при длине волны в уравнении, с последующим использованием таблицы калибровочной кривой или уравнения.
Уравнение Ламберта-Бера
Закомн Бугера -- Ламберта -- Бера -- физический закон, определяющий ослабление параллельного монохроматического пучка света при распространении его в поглощающей среде. Изменение интенсивности света, проходящего через любую среду, описывается законом Ламберта--Бера:
I=-I0 exp(-о-l) (1)

(2)
Где I--интенсивность прошедшего света;
I0--интенсивность входящего в среду свет;
L -- толщина поглощающего слоя;
Е - индивидуальная константа, зависящая от природы: вещества, длины световой волны и не зависящая от концентрации раствора;
С -- концентрация вещества.
Обычно е > 0, т. е, происходит ослабление проходящего света, но имеются особые среды, у которых е< 0 т. е. происходит усиление света - это лазерные среды.
Расчетная часть
Задача 1
Поток света с длиной волны л = 528нм, проходя через эмульсию CCl4 в воде толщиной слоя ?= 5 см, ослабляется в результате светорассеяния в два раза. Рассчитайте радиус частиц дисперсной фазы, если ее объемное содержание сv = 0,8%, показатель преломления для CCl4 и воды соответственно равны 1,460 и 1,333. Свет рассеивается в соответствии с уравнением Рэлея и ослабляется по закону Бугера-Ламберта-Бера.
Решение:
Уравнение Рэлея для интенсивности света, рассеиваемого единицей объема дисперсной системы во всех направлениях, имеет следующий вид:

Ip=.
Интенсивность света при прохождении через белый золь уменьшается в соответствии с уравнением Бугера-Ламберта-Бера:

;
По условию задачи. Тогда
;
Подставляя полученное значение ф в уравнение Рэлея, находим радиус капель эмульсии:


Ответ: 22,3 нм.
Задача 2
При исследовании методом поточной ультрамикроскопии Дерягина-Власенко водяного аэрозоля в видимом объеме 3,00*10-5 см3 прошедшем через счетное поле микроскопа, обнаружено в среднем 60 частиц. Вычислите радиус частиц аэрозоля, зная его концентрацию 15,0 мг/м3, плотность воды 1,0 г/см3.
Решение:
Масса частиц m (кг) в видимом объеме Vx равна:
.
Масса одной частицы m0 будет равна:


, где n-число частиц, видимых в микроскоп. Тогда средний радиус одной частицы аэрозоля: .
Ответ: 0,12145*10-6м.
Задача 3
Определите молярную массу и число агрегации мицелл хлорида додециламмония C12H25NH3Cl (молярная масса 221,8 г/моль) в водных растворах 0,01 молярного раствора NaCl при 30 оС по следующим данным о мутности:
С, г/л 3,20 4,10 5,10 6,10 7,35 8,15 10,15 12,15
Ф?103, м-1 12,00 21,13 29,04 34,84 40,41 43,32 49,46 54,36
Длина волны света л=436 нм, показатель преломления света в растворителе 1,332; инкремент показателя преломления ?n/?c = 0,160 см3/г.
Решение:
По экспериментальным данным строим график зависимости мутности от концентрации; по абсциссе точки пересечения двух прямых на графике находим смо = ККМ = 5,7 г/л и по ординате - соответствующее значение фмо.

Используя формулу, находим оптическую постоянную Н. Рассчитываем соответствующие значения Нcм /фм, данные сводим в таблицу и строим график (не показан) зависимости Нcм /фм (моль/кг) от с (кг/м3).

ККМ = 5,7 г/л.
Смо = 5,7 г/л; фмо = 5,74-10-3 м-1.
По экспериментальным данным для точек с большим значением, чем ККМ, рассчитываем концентрации ПАВ в составе мицелл (см) и соответствующие значения мутности (фм), используя расчетные формулы:
См=с-5,70; фм= ф-5,74-10-3.
|
С, кг/м3 |
Ф?103,м-1 |
См, кг/м3 |
Фм-103,м-1 |
Нcм/фм, оль/кг |
|
6,20 |
8,81 |
0,50 |
3,07 |
0,107 |
|
7,09 |
13,09 |
1,39 |
7,35 |
0,124 |
|
7,93 |
16,66 |
2,23 |
10,92 |
0,134 |
|
9,55 |
21,75 |
3,85 |
16,01 |
0,158 |
|
10,92 |
25,09 |
5,22 |
19,35 |
0,177 |
|
11,97 |
26,89 |
6,27 |
21,15 |
0,195 |
Полученную прямую экстраполируем до пересечения с осью Нc/ф ; при с = 0, отрезок на оси Нc/ф, равный 0,10 моль/кг будет равен 1/М. Отсюда 1/М = 0,10 и М = 10 кг/моль 10000 г/моль. Число агрегации мицелл n = 10000/263,88 = 37,9.
Похожие статьи
-
Концепция гидрофильно-липофильного баланса - Коллоидные поверхностно-активные вещества
В эмульсионной технологии существует эмпирическое правило: водорастворимые эмульгаторы обычно образуют эмульсии "масло в воде", в то время как...
-
Неионогенные ПАВ - Коллоидные поверхностно-активные вещества
Неионогенные ПАВ - высокомолекулярные соединения, не образующие ионов в водном растворе. Их растворимость обусловлена наличием в молекулах гидрофильных...
-
Ультрамикроскопия - Коллоидные поверхностно-активные вещества
Ультрамикроскопия (от лат. ultra, греч. mikros - маленький и skopeo - смотрю), оптический метод наблюдения и анализа коллоидных частиц в жидкой или...
-
Введение - Коллоидные поверхностно-активные вещества
Поверхностно-активные вещества (ПАВ) -- химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного...
-
Современные мутномеры - Коллоидные поверхностно-активные вещества
Хотя к настоящему времени разработано множество методов для определения загрязнений в воде, определение мутности по-прежнему важно, поскольку мутность -...
-
ПАВ и ПИВ - Коллоидные поверхностно-активные вещества
Одним из основных свойств поверхностно-активных веществ является их способность адсорбироваться из объема жидкости, где они растворены, на поверхности...
-
1) рассеяние света 2) флотация-всплывание каллоидных частиц на поверхность 3) сидиментация - выпадение в осадок коллоидных частиц 4)коагуляция-уменьшение...
-
Диспергированием называют тонкое измельчение твердых мате-риалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате...
-
Поляриметр. Удельное вращение - Оптические изомеры и их влияние на организм человека
Различить оптические изомеры можно с помощью поляриметра - прибора, измеряющего угол поворота плоскости поляризации. Величину оптической активности...
-
Формулы катионактивных ПАВ. - Коллоидные поверхностно-активные вещества
Катионактивные ПАВ меньше снижают поверхностное натяжение, чем анионактивные, но они могут взаимодействовать химически с поверхностью адсорбента,...
-
Катионактивные ПАВ - Коллоидные поверхностно-активные вещества
Катионактивными называют ПАВ, молекулы которых диссоциируют в водном растворе с образованием поверхностно-активного катиона с длинной гидрофобной цепью и...
-
КОЛЛОИДНЫЕ ВЕЩЕСТВА ПРИРОДНЫХ ВОД И ИХ УДАЛЕНИЕ - Химические свойства и строение воды
Очистка сточных вод -- лишь одно из направлений защиты гидросферы, прежде всего, поверхностных вод от антропогенных загрязнений. Главный путь защиты...
-
Специфические способы определения удельной свободной поверхностной энергии - Коллоидная химия
Поверхностная энергия , энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме. При увеличении поверхности раздела...
-
Применение коллоидных систем в повседневной жизни
I тип - суспензоиды (или необратимые коллоиды, лиофобные коллоиды). Коллоидные растворы металлов, их оксидов, гидроксидов, солей. Первичные частицы...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Адсорбция на границе жидкость - газ Сорбцией (от лат. "sorbeo" - поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорбтива) другим...
-
Способы очистки коллоидных систем - Общая характеристика дисперсных систем и методы их получения
Некоторые молекулярно-кинетические свойства коллоидных систем используют для очистки золей от электролитов и молекулярных примесей, которыми полученные...
-
Способы получения коллоидных систем - Общая характеристика дисперсных систем и методы их получения
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами и грубодисперсными системами. Поэтому коллоидные...
-
Жидкостное восстановление и радиолиз - Коллоидная химия
Энергия наночастица жидкостный радиолиз Жидкофазное восстановление. Жидкофазное восстановление. Химические восстановление зависит как от природы пары...
-
Основы теории растворов сильных электролитов - Растворы
Зная величину изотонического коэффициента, полученного экспериментально методами эбуллиоскопии и криоскопии, можно вычислить значение степени диссоциации...
-
ЖЦОК+ЦПВ+AgNO3=Кр+ Ag?+ H+ В мерную колбу емкостью 50 мл помещаем раствор ЦОК (пурпурный) в количестве 10 мл, ЦПВ - 10 мл, Na2CO3- 1 мл, для...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
СО2 + С = 2СО Если известно, что для СО2 ДG2980 = - 394572 Дж/моль и для СО ДG2980 = - 137334 Дж/моль. Рассчитаем ДG2980 = 2ДGСО - ДGСО2 = 2*(137,334)...
-
Задание 1, Задание 2 - Процентная концентрация растворенного вещества в растворе
Чему равна процентная концентрация растворенного вещества в растворе, если из 650 г. 10%-ного раствора выпарить 150 г. воды? Решение: 1. Определим массу...
-
Проявление молекулярно-кинетических свойств коллоидных систем неразрывно связано с их реологическими (вязкостными) свойствами. Реология - это наука о...
-
Препарат "Оранж" В течение войны в Индокитае 1961-1975 почти 10% территории юга Вьетнама подвергалось распылению phenoxy гербицидами, 34 % этой...
-
Спектральные и фотохимические характеристики исходных веществ Спектральные свойства 2-(4-[9-меркаптононокси] стирил) хинолина и квантовой точки CdS На...
-
Трехмерная проекция четырехмерного гиперкуба (3ПГК-4) - "Начала" многомерной геометрии
В работе "Постигая четырехмерное измерение, мы приходим к геометрии N -мерных пространств" [3] я определила метод построения (черчения) трехмерной...
-
Воздушная известь - одно из древнейших вяжущих, широко применяемых в строительстве и промышленности. Известь - продукт умеренного обжига кальциевых и...
-
Теплофизические и оптические свойства молока - Химия и физика молока
1).Удельная теплоемкость. 2).Коэффициент теплопроводности и температуропроводности. 3).Показатель преломления. Теплофизические свойства молока Для...
-
Влияние различных факторов на растворимость веществ - Растворы
Растворимость зависит от природы растворяемого вещества и растворителя, температуры, давления и влияния посторонних веществ. Природа веществ, образующих...
-
Принцип определения химического состава вещества любым методом сводится к тому, что состав вещества определяется по его Свойствам . Свойства веществ...
-
Хлорорганические соединения - Химико-токсилогический анализ на отдельные группы веществ. Пестициды
Физико-химические свойства и применение. Хлорорганические соединения (ХОС) широко применяют в качестве инсектицидов, акарицидов и фунгицидов для борьбы с...
-
Коллоидная система молока - Химия и физика молока
1). Характеристика дисперсной фазы. 2). Структура мицелл казеина. 3). Коагуляция. В коллоидно-дисперсном состоянии в молоке находятся сывороточные белки,...
-
Методы очистки коллоидных растворов - Методы очистки и получения коллоидных растворов
При получении коллоидных растворов тем или иным методом, особенно с помощью химических реакций, практически невозможно точно предусмотреть необходимое...
-
Гетерогенные процессы в системе "газ - твердое вещество" - распространенный вид промышленных химико-технологических процессов. Это процессы обжига...
-
Конденсационные методы получения коллоидных систем - Методы очистки и получения коллоидных растворов
Из классификации дисперсных систем по размеру частиц следует, что коллоидные растворы (золи) занимают промежуточное положе-ние между молекулярными и...
-
Класс алкилбензолов представлен 37 соединениями в табл.3, где приведены экспериментальные данные, использованные нами при определении значений параметров...
-
Поляризация света и оптическая активность - Оптические изомеры и их влияние на организм человека
В начале 19 в. английский физик, астроном и врач Томас Юнг показал, что свет можно рассматривать как волну. Французский физик Огюстен Френель установил,...
-
Основные положения стереохимии Стереохимия Стереохимия или структурная химия(от греч. уфесеьт -- твердый, пространственный), -- раздел химии о...
Оптическая геометрия нефелометров - Коллоидные поверхностно-активные вещества