Адсорбция как частный случай сорбции - Поверхностные явления. Контакт трех фаз. Когезия, адгезия, смачивание, растекание
Адсорбция на границе жидкость - газ
Сорбцией (от лат. "sorbeo" - поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорбтива) другим (сорбентом), независимо от механизма поглощения.
Любой сорбционный процесс начинается с адсорбции на границе соприкасающихся фаз, которые могут быть жидкими, газообразными или твердыми.
В зависимости от механизма сорбции различают 4 вида сорбции:
|
Адсорбция - изменение концентрации вещества на границе раздела фаз, происходит на любых межфазных поверхностях, адсорбируются любые вещества (поглощается - адсорбат (адсорбтив), поглощает - адсорбент). |
Абсорбция - явление поглощения одного вещества другим не только на поверхностном слое, но и в объеме сорбента (растворение газа в жидкости). |
Хемосорбция - поглощение одного вещества другим, которое сопровождается химической реакцией (аммиака или хлороводорода водой, поглощение углекислого газа оксидом кальция). |
Капиллярная конденсация - ожижение паров в микропористых сорбентах, происходит вследствие того, что давления паров под вогнутым мениском жидкости в смачиваемых ею узких капиллярах меньше, чем давление насыщенного пара над плоской поверхностью жидкости при той же температуре. |
В зависимости от агрегатного состояния адсорбата и адсорбента разделяют:
|
Адсорбция на границе жидкость (раствор) - газ |
Адсорбция на границе твердое тело - газ |
Адсорбция на границе твердое тело - жидкость (раствор) |
Процессы адсорбции в соответствии с типом взаимодействия адсорбата и адсорбента (природы адсорбционных сил), классифицируют:
|
Физическая адсорбция |
Химическая адсорбция обычно необратима, адсорбционные силы имеют химическую природу. |
|
Осуществляется за счет сил ВДВ и водородных связей, которые вызывают конденсацию газов. Адсорбтив стремится целиком занять всю поверхность адсорбента, но этому препятствует процесс, противоположный адсорбции, - десорбция, вызванный, как и диффузия, стремлением к равномерному распределению вещества вследствие теплового движения. Физическая адсорбция всегда обратима и мало специфична. Теплота адсорбции составляет 2 - 8 ккал-моль-1 и соизмерима с теплотой конденсации. Повышение температуры уменьшает адсорбцию (экзо термический процесс). Таковой является, например, адсорбция инертных газов на угле. | |
|
Хемосорбция |
Обменная адсорбция - |
|
Осуществляется за счет химических сил, десорбция протекает с большим трудом и часто вещество десорбируется химически измененным. Часто физическая адсорбция предшествует химической - адсорбтив, адсорбированный поверхностно в результате физических сил, затем связывается с адсорбентом уже химическими силами. Теплота абсорбции достигает 200 ккал-моль-1, т. е. имеет порядок теплот химических реакций. Протекает хемосорбция обычно при сравнительно высоких температурах. Повышение температуры способствует адсорбции. |
Обмен ионов между двойным электрическим слоем адсорбента и средой. При обменной адсорбции адсорбент, поглощая определенное количество других ионов, выделяет одновременно в раствор эквивалентное количество других ионов того же знака, вытесненных с поверхности. |
С + СН3СООН - С-СН3СООН
Адсорбент адсорбат адсорбционный комплекс
Адсорбция может протекать в двух случаях:
- 1. На поверхности жидкости, при этом возможные границы: ж - ж, ж - газ. Площадь поверхности в этом случае вычисляют легко и измеряют адсорбцию как [моль/м2]. 2. На поверхности твердого тела. Возможные границы: ж - тв, ж - газ (противогаз). Для твердой адсорбции площадь раздела вычислить трудно, т. к. на поверхности твердого тела имеется большое количество пор, поэтому определяют количество адсорбированного вещества [моль/г], [л/г]. Адсорбент с развитой внутренней поверхностью характеризуется удельной поверхностью, т. е. поверхностью, приходящейся на 1г сорбента (активированный уголь, силикагель - аэрогель, обезвоженной кремневой кислоты).
Дисперсные системы характеризуются большой поверхностью раздела фаз и обладают значительной адсорбционной способностью. У пористых адсорбентов резко увеличивается площадь раздела фаз не только в результате дисперсности, но и за счет площади самих пор. Например, SУд сах. пудры = 0,5 м2/г, SУд акт угля = 500 м2/г (одна таблетка активированного угля m = 0,25 г, SУд акт угля = 125 м2). При очистке крови от токсических веществ применяется модифицированный альбумином, ацетатом целлюлозы активированный уголь. Общая поверхность эритроцитов человека достигает 3200м2. Большое значение имеет адсорбция веществ на поверхности клеточных мембран, с помощью которых клетка взаимодействует с внеклеточной средой и осуществляет контакт с другими клетками.
Связь адсорбции и поверхностного натяжения
Поверхностное натяжение зависит от природы растворителя и растворенного вещества, концентрации растворенного вещества и температуры.
Вещества по их способности адсорбироваться на границе жидкость - воздух разделяются на две группы:
- - уменьшают поверхностное натяжение чистого растворителя у0 и в таком случае их называют ПАВ; - повышают поверхностное натяжение чистого растворителя у0 и в таком случае они являются поверхностно инактивными веществами ПИАВ; - не влияют на поверхностное натяжение чистого растворителя у0.
В водных растворах ПАВ - это полярные органические соединения (спирты, кислоты, амины, фенолы), способны накапливаться в поверхностном слое. ПАВ делятся на: истинно растворимые в воде (дифильные молекулы с короткими углеводородными радикалами) и мицеллярные коллоиды (дифильные молекулы с длинными углеводородными радикалами, малорастворимые в воде).
ПИАВ стремятся уйти с поверхности жидкости в объем, ими являются сильные неорганические электролиты - кислоты, щелочи, соли; из органических соединений - муравьиная, аминоуксусная кислоты. Молекулы этих веществ не имеют гидрофобной части, хорошо диссоциируют в воде с образование гидратированных ионов. Более гидратированные ионы вызывают большее повышение поверхностного натяжения: Cl- > Br- > I- ; Li+ > Na+ > K+ > Rb+; K+ > Ca2+ в эквимолярных растворах, что объясняется их способностью поляризоваться и гидратироваться в зависимости от радиуса.
Понятия ПАВ и ПИАВ относительны, т. е. это не абсолютное свойство вещества, а зависит от природы поверхности раздела фаз: обычно ПАВ вещество, которое имеет более низкое собственное у.
Вещества, которые не влияют на поверхностное натяжение растворителя, распределяются равномерно между поверхностным слоем и объемом раствора, например, сахара на границе водного раствора и воздуха.
Зависимость поверхностного натяжения растворов при постоянной температуре от концентрации растворенного вещества называют изотермой поверхностного натяжения (рис. 11).
Если у0 - поверхностное натяжение чистого растворителя, а у - растворенного вещества, то у0 < у для ПАВ; у0 > у для ПИАВ; у0 ? у для веществ, не влияющих на поверхностное натяжение растворителя.
Рис. 11. Изотермы поверхностного натяжения растворов: 1 - раствор ПАВ; 2 - раствор вещества, не влияющего на поверхностное натяжения растворителя; 3 - раствор ПИАВ.
Количественно адсорбция может быть выражена разными величинами.
Разность концентраций растворенного вещества в поверхностном слое и в таком же слое внутри объема раствора, отнесенным к единице площади поверхности, называется поверхностным избытком этого вещества (Гиббсовская адсорбция) - Г [моль/дм3].
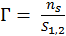
,
Где - число молей адсорбата, приходящегося на разделенную поверхность.
, - общее число молей i-го компонента в системе; и - число молей того же компонента в каждой из соприкасающейся фаз.
Т. е. Г определяется как избыток количества адсорбата в объеме поверхностного слоя по сравнению с количеством адсорбата в равном объеме объемной фазы к единице площади поверхности или массы адсорбента:
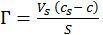
,
Где VS - объем поверхностного слоя; cS - равновесная концентрация адсорбата в объеме поверхностного слоя, c - равновесная концентрация адсорбата в объемной фазе, за пределами поверхностного слоя.
Разность концентраций растворенного вещества в поверхностном слое и в таком же слое внутри объема раствора, отнесенным к единице массы адсорбента, называется удельной адсорбцией - ??I [моль/кг] или [кг/кг].
Абсолютная адсорбция А - количество вещества в поверхностном слое, приходящегося на единицу площади поверхности [моль/дм3], [моль/м2].
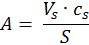
Величину абсолютной адсорбции сложно определить на практике, поэтому чаще используют гиббсовскую адсорбцию.
Рассмотрим адсорбцию на поверхности раздела раствор - воздух. Молекулы спиртов (ROH) в поверхностном слое раствора самопроизвольно ориентированы таким образом, что неполярная углеводородная часть радикала выходит из воды в соседнюю неполярную фазу (воздух), а полярная гидрофильная группа - ОН взаимодействует с водой и остается в водной фазе (рис. 12). Такая ориентация и обеспечивает снижение свободной поверхностной энергии раствора и поверхностного натяжения. С увеличением общей концентрации раствора величина адсорбции растет и молекулы ПАВ в адсорбированном слое сближаются и в пределе (когда концентрация стремится к бесконечности) образуют плотно упакованный монослой - частокол Ленгмюра.
Рис. 12. Схема ориентации дифильных молекул на границе раздела фаз.
Величина поверхностного натяжения при этом снижается до минимального значения, а адсорбция достигает предельной величины. Энергия ВДВ взаимодействия углеводородного радикала с полярными молекулами воды меньше, чем энергия взаимодействия молекул воды между собой, следовательно, на границе раздела водный раствор/воздух радикалы R самопроизвольно переходят в соседнюю фазу, что является энергетически выгодно и обнаруживается как уменьшение поверхностного натяжения (поверхностной энергии).
Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция (Г?) не зависит от длины углеводородного радикала, и определяется только размерами поперечного сечения молекулы.
Экспериментально найденная величина адсорбции дает возможность рассчитать поперечный размер молекулы (S0). Т. к. поверхностный слой образует мономолекулярный плотный слой молекул ПАВ, то
, NA - число Авогадро.
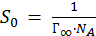
Тогда или.
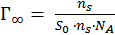
Фундаментальное уравнение адсорбции Гиббса
Для любой гетерогенной системы, объединенное уравнение I и II начала термодинамики можно представить в виде:
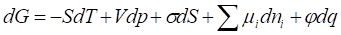
,
Где dG - энергия Гиббса, S - энтропия, Т - температура, V - объем, р - давление, у - поверхностное натяжение, S - площадь поверхности, - химический потенциал компонента ??I; nI - число молей компеонента i; ?? - электрический потенциал; q - количество электричества.
Уравнение выражает приращение энергии Гиббса системы через алгебраическую сумму приращений других видов энергии. Из этого уравнения видно, что возможны следующие превращения поверхностной энергии: а) в энергию Гиббса, б) в теплоту, в) в химическую энергию, г) в механическую энергию, д) в электрическую энергию.
Превращение поверхностной энергии отвечает определенным поверхностным явлениям: изменение реакционной способности с изменением дисперсности; адгезия и смачивание; капиллярность адсорбция; электрическая способность.
В результате адсорбции происходит перераспределение компонентов между объемными фазами и поверхностным слоем, что влечет за собой изменение их химических потенциалов в системе, поэтому этот процесс можно рассматривать как превращение поверхностной энергии в химическую.
При адсорбционных процессах снижение свободной поверхностной энергии связано с изменением внутренней энергии. Таким образом, объединенное уравнение I и II начала термодинамики для внутренней энергии поверхности с учетом поверхностей и их химической энергии имеет вид:
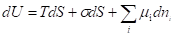
Т. к. внутренняя энергия поверхности пропорциональна, то:
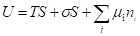
При дифференцировании этого уравнения получаем:
=>
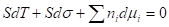
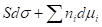
При Т = const: = 0 - уравнение Гиббса для межфазовой поверхности
Т. к. внутренняя энергия, энтропия, число молей зависят от площади, то разделим уравнение Гиббса для межфазной поверхности на площадь:
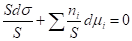
, =>
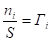
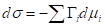
- фундаментальное уравнение адсорбции Гиббса
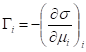
Для разбавленных растворов, где и - равновесный и стандартный химические потенциалы адсорбата I соответственно, c - концентрация адсорбата, R - универсальная газовая постоянная (8,314 Дж/моль-К).
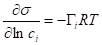
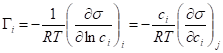
,
Где 1 - растворитель, 2 - растворенное вещество.
Для разбавленного раствора химический потенциал изменяется очень слабо = 0.
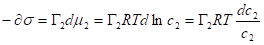
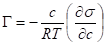
- уравнение изотермы Гиббса
Справедливо для растворов
Если система твердое вещество - газ, то уравнение изотермы Гиббса имеет следующий вид:
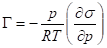
Уравнение изотермы Гиббса позволяет экспериментально установить зависимость адсорбции от концентрации растворенного вещества. Для построения графика необходимо выбрать несколько точек на графике, провести касательные к ним и определить тангенс угла. Т. к.
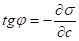
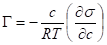
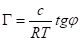
, а, то.
Для каждой точки (концентрации) вычисляется адсорбция и строится график зависимости - изотерма адсорбции (рис. 13).
Рис. 13. Изотерма поверхностно активно избытка Г в растворе ПАВ на границе раствор - пар: а - чистый растворитель; б - ненасыщенный мономолекулярный слой ПАВ; в - насыщенный мономолекулярный слой ПАВ.
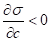
Поскольку наличие молекул ПАВ в поверхностном слое энергетически выгодно, то происходит самопроизвольное концентрирование растворенного вещества на межфазной границе.
В уравнении Гиббса влияние природы веществ на адсорбцию отражает производная и может служить характеристикой поведения веществ при адсорбции. Чтобы исключить влияние концентрации на производную, берут ее предельное значение при С>0. Мерой активности ПАВ по П. А. Ребиндеру является способность его к понижению поверхностного натяжения - поверхностная активность:
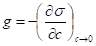
Физический смысл поверхностной активности: сила, которая удерживает вещество на поверхности на единицу площади адсорбции.
Гиббсовская адсорбция и поверхностная активность увеличивается при уменьшении поверхностного натяжения системы. Поскольку поверхностное натяжение органических жидкостей возрастает с увеличением их полярности, то поверхностная активность будет уменьшаться (поверхностная активность органических кислот больше поверхностной активности соответствующих им солей органических кислот).
Высокая поверхностная активность коллоидных ПАВ зависит главным образом от длины углеводородного радикала. Увеличение радикала на одну СН2 группу приводит к возрастанию поверхностной активности приблизительно в 3,2 раза.
Д. Дюкло (1878) и И. Траубе (1884 - 1886) выявили закономерность: одинаковое понижение поверхностного натяжения может быть достигнуто при концентрации каждого последующего гомолога с более длинной углеводородной цепью меньшей в 3 - 3,5 раза:
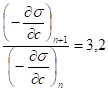
- правило Дюкло - Траубе
Это правило справедливо для истинно растворимых ПАВ, т. к. поверхностную активность определяют при бесконечном разбавлении системы. Чем длиннее радикал, тем сильнее выталкиваются ПАВ из водного раствора (уменьшается растворимость). Молекулы идут к поверхности раздела фаз и понижается поверхностное натяжение раствора (рис. 14).
Рис. 14. Изотермы поверхностного натяжения для трех ПАВ - соседних гомологов (правило Дюкло-Траубе).
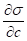
В зависимости от показателя различают положительную и отрицательную адсорбцию:
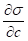
- А) для ПАВ - если < 0, г > 0, g > 0 - положительная адсорбция, т.е. концентрация в поверхностном слое больше, чем в глубине фазы; Б) для ПИАВ - если > 0, Г < 0, g < 0 - отрицательная адсорбция, при этом поверхностное натяжение несколько возрастает в результате того, что в растворах сильных электролитов поверхностные молекулы воды втягиваются внутрь раствора с большей силой, чем в чистой воде.
Зависимость изменения поверхностного натяжения от концентрации ПАВ удовлетворительно описывает эмпирическое уравнение Шишковского.
- уравнение Шишковского,
Где c - концентрация адсорбируемого вещества; у - поверхностное натяжение раствора; у0 - поверхностное натяжение воды; В - константа, мало зависит от природы ПАВ для некоторого гомологического ряда; К - постоянная, которая характеризует индивидуальное вещество, указывает на величину радикала (увеличивается в 3 - 3,5 раза при удлинении цепи на - СН2- группу).
При максимальной адсорбции количество площади поверхности на одну молекулу остается постоянным в пределах гомологического ряда, т. е. уравнение Гиббса преобразуется в, A - постоянная интегрирования. Если уравнение Шишковского преобразовать для условия предельной адсорбции, т. е. с >>>1, тогда Kc>>>1 и (1 + Kc) ? Kc, то получим или.
Сравнивая уравнения Гиббса и Шишковского для случая предельной адсорбции видно, что константа В равна
.
Изменение поверхностного натяжения в результате адсорбции описывает уравнение Фрумкина:
.
Похожие статьи
-
Поверхностный натяжение адсорбция адгезия Поверхностное натяжение различных конденсированных тел на границе с газом непосредственно связано с межатомным...
-
Адгезия, смачивание и растекание относятся к межфазным взаимодействиям, которые происходят между конденсированными фазами. Адгезия. Межфазное...
-
Адсорбция Лэгмюра и Фрейндлиха
Адсорбция. Изотермы адсорбции Лэгмюра, Фрейндлиха. Уравнение БЭТ и его анализ Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается...
-
Способность минералов закрепляться на поверхности раздела воздух - вода (или в общем случае газ - жидкость) зависит от степени полярности минеральной...
-
Адсорбенты Применяемые адсорбенты характеризуются адсорбционной активностью, истинной и насыпной плотностью, удельной поверхностью общим объемом пор и их...
-
Специфические способы определения удельной свободной поверхностной энергии - Коллоидная химия
Поверхностная энергия , энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме. При увеличении поверхности раздела...
-
Газовый хроматография энтропия адсорбция Области физико-химических применений газовой хроматографии Газовая хроматография, имеющая главным образом...
-
Основной и определяющей стадией флотационного процесса является элементарный акт флотации, под которым подразумевают закрепление единичного зерна на...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Адсорбция активированный уголь Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и...
-
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ - Растворы
Коллигативными свойствами называют физико-химические свойства растворов, которые обусловлены Природой растворителя и числом частиц растворенного вещества...
-
Анализ модели - Кинетические закономерности взрывного свечения азида серебра
Рассмотрим процесс развития реакции при произвольной степени разложения. Нас будет интересовать вид кинетических зависимостей концентрации носителей цепи...
-
Результаты исследований А. Н. Фрумкина и Б. В. Дерягина показали, что характер изменения удельной поверхностной энергии е прослоя воды, находящегося...
-
Сорбция - Подготовка проб к анализу, разделение и концентрирование компонент природных вод
Сорбцию широко используют для разделения и концентрирования веществ. Сорбционные методы обычно обеспечивают хорошую селективность разделения, высокие...
-
Чтобы возникла поверхность раздела фаз, нужна затрата энергии - Еа зародышеобразования. А когда новая фаза уже появилась, ее дальнейший рост идет...
-
Понятие квантовой химии - Квантовые концепции в химии
Квантовая химия - это раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействие и превращение в химических...
-
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества,...
-
Тепловые эффекты при растворении. Механизмы растворения веществ в воде - Растворы
Растворение веществ сопровождается различными тепловыми эффектами в зависимости от природы вещества. При растворении в воде, например, гидроксида калия...
-
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия,...
-
ТЕРМОХИМИЯ - Химическая термодинамика. Термохимия. Решение задач
Уравнения химических реакций, учитывающие тепловые эффекты, называются термохимическими уравнениями. Например: 2Н2(г.)+О2(г.) = 2Н2О(г.); ДН = - 476 кДж....
-
Следует отметить, что не существует особых сил, вызывающих адсорбцию. Адсорбция молекул на поверхности твердого тела происходит за счет сил притяжения со...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Попытаемся дать общее представление о свойствах и применении адсорбентов на примере весьма распространенных углеродных материалов. Углеродные адсорбенты...
-
Знаменитая теория полимолекулярной адсорбции Брунауэра, Эммета и Теллера, получившая название теории БЭТ (по первым буквам фамилий ученых), основана на...
-
ПРЕВРАЩЕНИЯ ВЕЩЕСТВ. - Строение и превращение веществ
Для получения разнообразных веществ применяются как физические, так и химические методы. К первым относятся, например, растворение в воде, фильтрование и...
-
Моющие средства: состав и свойства
1. Природа моющих средств Моющими средствами называют сложные органические соединения, применяемые в чистом виде или с добавками для стирки изделий из...
-
Способы получения коллоидных систем - Общая характеристика дисперсных систем и методы их получения
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами и грубодисперсными системами. Поэтому коллоидные...
-
ДИСПЕРСНЫЕ СИСТЕМЫ - Неограническая химия
Задание 5.1. В определенном объеме раствора V л содержится m г вещества. Плотность раствора с (табл. V.1). Рассчитайте: 5.1.1. Процентную концентрацию...
-
Общая схема исследования: 1. Составление среднего образца. 2. Извлечение пестицидов из пробы. 3. Очистка экстракта. 4. Анализ экстракта. Прием образцов в...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Возможности подбора и синтеза неорганических сорбентов с заданными свойствами практически неисчерпаемы. Это обусловлено тем, что в качестве сорбентов...
-
Третье начало термодинамики - Физическая химия
Третий закон термодинамики (постулат Планка). Термодинамические потенциалы. Энергия Гельмгольца и энергия Гиббса как критерии направленности и предела...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
"Катализ. Гомогенный и гетерогенный катализ" - Гомогенный и гетерогенный катализ
В 1835 году Берцелиус впервые использовал термин "катализатор" для обозначения "веществ, которые способны пробудить сродство, дремлющее при данной...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Основы теории растворов сильных электролитов - Растворы
Зная величину изотонического коэффициента, полученного экспериментально методами эбуллиоскопии и криоскопии, можно вычислить значение степени диссоциации...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Диффузия в металлах - Изменение физико-химических свойств материалов путем диффузии
Диффузией называется процесс перемещения частиц вещества в направлении меньшей его концентрации. В результате диффузии происходит выравнивание состава...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
ГИСТЕРЕЗИС СМАЧИВАНИЯ - Флотационный метод обогащения
Явление гистерезиса, затрудняющего достижение равновесного состояния, присуще многим физическим и физико-химическим процессам, в том числе процессу...
Адсорбция как частный случай сорбции - Поверхностные явления. Контакт трех фаз. Когезия, адгезия, смачивание, растекание