Электрохимические явления на границе цинк-раствор, медь-раствор. Электродный потенциал. Уравнение Нернста - Основы химии
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа - например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn2+ // Cu2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов - электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае - цинкового) на электрод с более положительным зарядом (медный), т. е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие - на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном - из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Zno --> Zn2+ + 2е-Сu2+ + 2е - --> Сuo
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется Анодом, электрод, на котором идет процесс восстановления - Катодом. При схематическом изображении гальванических элементов слева записывают анод, справа - катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu2+ + Zno --> Сuo + Zn2+
Т. о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ДЦ и количеством прошедшего по цепи электричества
Q: (III.39)
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента.
Электродным потенциалом электрода еэ называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как "разность потенциалов на границе электрод - раствор", т. е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны). Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается Уравнением Нернста (здесь F - постоянная Фарадея, z - заряд иона):
В уравнении Нернста е° - Стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина е° есть мера способности окисленной формы элемента или иона принимать электроны, т. е. восстанавливаться.
|
Основные |
Амфотерные |
Кислотные |
|
Основные-реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1. Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2. Все-с кислотами AI2O3+6HCl=2AlCl3+3H2O 3. С кислотнями оксидами CaO+CO2=CaCO3 4. С амфотерными оксидами Li2O+Al2O3=2LiAlO2 |
Амфотерные (ZnO, Al2O3,Cr2O3, MnO2) 1. Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2. Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 |
Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1. Большинство взаимодействуют с водой SO3+H2O=H2SO4 2. Со щелочами NaOH+SiO2=Na2SiO3+H2O 3. С основными оксидами SiO2+CaO=CaSiO3 4. С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
Похожие статьи
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Гальванический элемент. ЭДС гальванического элемента - Основы химии
Рассмотрим простейший гальванический элемент Даниэля - Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Коррозия - это самопроизвольный процесс разрушения металлов и сплавов в результате окислительно-восстановительного (химического, электрохимического и...
-
ОСНОВЫ ЭЛЕКТРОХИМИИ - Неограническая химия
Задание 6.1. В данной (табл. VI.1) окислительно-восстановительной реакции уравняйте стехиометрические коэффициенты ионно-электронным методом и...
-
Способы получения и химические свойства солей - Основы химии
1. С использованием металлов Металл+неметалл Mg+Cl2=MgCl2 Металл+кислота Zn+2HCl=ZnCI2+H2 Металл+соль Fe+CuSO4=FeSO4+Cu 2. С использованием оксидов...
-
Растворы электролитов. Диссоциация кислот, солей и оснований - Основы химии
Электролиты - вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Зарождение современной химии, Теория флогистона и система Лавуазье - Химия сегодня
Представления древнегреческих натурфилософов оставались основными идейными истоками естествознания вплоть до XVIII в. До начала эпохи Возрождения в науке...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
Причинность, регрессия, корреляция Исследование объективно существующих зависимостей и взаимосвязей между явлениями и процессами - важнейшая задача...
-
Способы получения и химические свойства кислот - Основы химии
Бескислородные кислоты получают: 1. Взаимодействием неметалла с водородом. Например H2 + Cl = 2HCl 2. Действием на соль более сильной или менее летучей...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
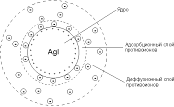
Введение - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
С развитием современной металлообрабатывающей промышленности и непрерывным ростом ассортимента изделий из металлов постоянно расширяется область...
-
Физические свойства меди. Применение в медицине и в народном хозяйстве - Медь
Медь -- тяжелый розово-красный металл, мягкий и ковкий, ее температура плавления 1083° С, является отличным проводником электрического тока и теплоты...
-
В XVI веке были предприняты первые попытки выплавлять цинк в заводских условиях. Но производство "не пошло", технологические трудности оказались...
-
Комплексные соединения, их номенклатура, типы, строение, свойства - Основы химии
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Согласно...
-
Алюминий - основной представитель металлов главной подгруппы III группы Периодической системы. Свойства его аналогов - галлия, индия и таллия -...
-
Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью...
-
Основные классы неорганических соединений
Классификация неорганических веществ прошла долгий путь развития и складывалась постепенно, начиная с первых опытов алхимиков, вплоть до наших дней,...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Как бы громко ни называли в наше время: "век полимеров", "век полупроводников", "атомный век" и так далее, по сути дела мы не вышли еще из века...
-
Электрохимическая защита, Силикатные покрытия - Коррозия металлов
В производственных условиях используют также электрохимический способ - обработку изделий переменным током в растворе фосфата цинка при плотности тока 4...
-
Металлы и сплавы в химии и технике - Металлы и сплавы в химии и технике
Химические элементы - это элементы, образующие в свободном состоянии простые вещества с металлической связью. Из 110 известных химических элементов...
-
Математическое моделирование - Основы научных исследований
Выше уже указывалось, что Математическое моделирование - это получение решений уравнений, составляющих математическую модель объекта, при изменении...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Теллур - Химия элементов VI группы
Теллур -- химический элемент 16-й группы, 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium) . Атом...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Кремний - элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14....
-
Положение металлов в ПС. Физические свойства металлов. Методы получения металлов - Основы химии
Металлы располагаются в основном в левой и нижней части ПС К физическим свойствам относятся плотность, плавление (температура плавления),...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Свойства растворов неэлектролитов. Замерзание и кипение растворов. Законы Рауля - Основы химии
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты - проводящие электрический ток, и неэлектролиты - не...
Электрохимические явления на границе цинк-раствор, медь-раствор. Электродный потенциал. Уравнение Нернста - Основы химии