Химическое равновесие - Скорость химических процессов. Химическое равновесие, принцип Ле-Шателье
Химическое равновесие и его признаки. Равновесие истинное и заторможенное (ложное). Принцип Ле-Шателье. Константа равновесия и ее связь с термодинамическими функциями. Химическое равновесие в гетерогенных системах.
Любой процесс приводит систему в состояние, при котором в ней не наблюдается никаких изменений при неизменных условиях. Такое состояние системы называется состоянием равновесия. Это весьма распространенное в природе состояние, которое достигается как при физических процессах, (испарение, растворение и т. д.) так и при химических реакциях. Поскольку законы физического и химического равновесия тождественны, их можно рассматривать совместно, называя законами физико-химическими равновесия.
Прежде чем перейти к рассмотрению законов равновесия, необходимо остановиться на тех признаках, по которым можно судить о наличии в системе этого состояния. Один из признаков равновесия - это неизменность системы со временем.
Однако этот признак является необходимым, но не достаточным. Никогда нельзя с уверенностью утверждать, что в системе нет изменений, так как неизвестно, сколько надо наблюдать за ней для того, чтобы констатировать изменения. Это зависит от скорости протекающих процессов: в системе в одну сторону может протекать процесс, но с такой малой скоростью, что практически невозможно заметить в ней изменения (за время, которым располагает исследователь). В этих случаях говорят, что система находится в состоянии ложного, или заторможенного, равновесия.
Если, например, смешать Н 2 и О 2, то в смеси происходит реакция:
- 2Н 2 (газ) +О 2(газ) = 2Н 2О(ж) ?Н ?S ?G = ?Н - Т?S
Т. е. низкие температуры способствуют протеканию прямого процесса.
Для обратного процесса Т>50000С.
Реакции, которые при определенных условиях одновременно протекают в двух взаимно противоположных направлениях, называются обратимыми.
Для реакции
АА + bВ = сС + dD
Vпр. = kпр [А]а [В]b Vобр. = kобр [С]с [D]d
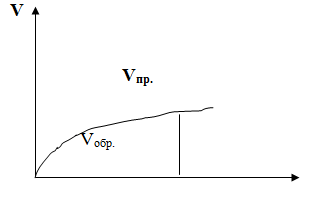
Состояние системы, в которой одновременно протекают два взаимно противоположных процесса с равными скоростями, называется Равновесным.
Условие истинного равновесия: ?G=0.
Несмотря на то, что концентрации исходных компонентов и продуктов реакции остаются постоянными при фиксированных внешних условиях, процессы не прекращаются, а идут в 2-х взаимно противоположных направлениях с равными скоростями. Это и есть Динамическая характеристика равновесия.
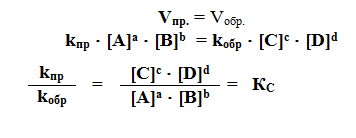
КС - концентрационная константа равновесия. Зависит от температуры и Еакт. Применяется к стехиометрическому уравнению.
[А], ... - молярные концентрации веществ.
Для газообразных реакций константа выражается через парциальные давления:
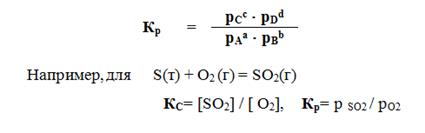
Если на равновесную систему оказать внешнее воздействие, то система изменит свои параметры, т. е. равновесие сместится.
Принцип Ле-Шателье: Если на равновесную систему оказать внешнее воздействие, то равновесие сместится в сторону, уменьшающую это воздействие.
Зависимость смещения равновесия от:
1) температуры
При увеличении температуры равновесие смещается в сторону эндопроцесса.
А) экзотермический процесс ?Н <0, при t
Равновесие смещается в сторону образования исходных веществ.
Б) эндотермический процесс ?Н >0, при t
Равновесие смещается в сторону образования продуктов.
Например, Бурый газ NO2 превращается в бесцветный газ N2O4 c выделением тепла. Около 0ОС в равновесной смеси преобладает N2O4, а около 100ОС NO2.
- 2NO2 N2O4; Kp= pN2O4 / (pNO2)2 2) концентрации А) при увеличении концентрации исходных веществ равновесие сместится в сторону образования продуктов реакции Б) при увеличении концентрации исходных веществ равновесие сместится в сторону образования продуктов реакции 3) давления (для газов)
При увеличении давления равновесие смещается в сторону с меньшим числом частиц.
При повышении давления, по принципу Ле-Шателье, Усиливается реакция, идущая со снижением объема и наоборот. Рассмотренная реакция с оксидами азота приводит к уменьшению объема (из двух молей исходного газа получается 1 моль газа-продукта), поэтому при повышении давления в равновесной смеси становится больше N2O4.
Опыты:
1) взаимодействие тиосульфата натрия с раствором серной кислоты:
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + Sv.
S2O32- + H+ S + HSO3-
Появление мелкокристаллической серы вызывает опалесценцию (помутнение) раствора. По этому признаку можно косвенно судить о скорости протекающей реакции
Зависимость смещения равновесия от:
Похожие статьи
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Смещение равновесия Смещение равновесия - это изменение состояния равновесия (изменение равновесного соотношения количеств исходных веществ и продуктов)...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
Принцип Ле Шателье - Систематика химических элементов
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций и минимальному значению энергии Гиббса (G0Т=0), является наиболее...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика
А) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S Одновременно действуют обе тенденции...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
Общие понятия и определения. Термодинамический и кинетический критерий реакционной способности химической системы. Скорость химической реакции. Факторы,...
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
Энтропия. Движущее начало химических процессов - Химическая термодинамика. Термохимия. Решение задач
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: "Почему одни химические реакции...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Заготовьте в тетради заранее таблицу для записи исходных данных и результатов опытов. Сейчас в нее внесены некоторые предполагаемые объемы растворов, но...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Второе начало термодинамики. Энтропия Из предыдущих глав мы знаем много обратимых процессов, но есть и необратимые, например: - переход тепла от горячего...
-
При нагревании (подводе тепла) равновесие смещается в сторону протекания эндотермической реакции (поглощения этого тепла), а при охлаждении - в сторону...
-
Влияние концентрации - Химическая кинетика, равновесия, термодинамика
При возрастании концентрации какого-то из веществ (исходных или продуктов) равновесие смещается в сторону его расходования, а при уменьшении концентрации...
-
Морфология процессов - Системная революция и принцип дуального управления
В функциональном (структурно-процессуальном) плане реальная система представляет собой совокупность трех взаимосвязанных функциональных подсистем:...
-
Электрохимические процессы, Электродный потенциал - Систематика химических элементов
Электродный потенциал Электрохимические процессы - Это процессы взаимного превращения химической и электрической форм энергии. Их можно разделить на две...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
Первое начало термодинамики. Энтальпия - Химическая кинетика, равновесия, термодинамика
Это закон сохранения энергии. Подводимая к системе теплота Q расходуется на изменение ее внутренней энергии и на совершение работы А: Q = U + А Здесь U =...
-
В этой части практикума опыты качественные, без расчетов. Влияние температуры Предлагается запаянный двухколенный стеклянный сосуд, заполненный оксидом...
-
Задачи и упражнения по химическому равновесию - Химическая кинетика, равновесия, термодинамика
При решении расчетных задач используйте цифровые данные из Приложения. Примеры решения подобных задач можно найти в задачнике Глинки [3, 4]. 1. От чего...
-
Выбор оптимальных условий проведения реакций - Химическая кинетика, равновесия, термодинамика
Если наша цель - получить максимальный выход продукта за определенное небольшое время, а реакция медленная и обратимая, то нужно одновременно учитывать...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
Фактически это следствие первого начала термодинамики, но сформулирован раньше, чем первое начало. Тепловой эффект изобарного (или изохорного) процесса...
-
Принципы оптимальности в изучении социально-экономических процессов рынка труда
Принципы оптимальности в изучении социально-экономических процессов рынка труда Муравьева Мария Петровна С точки зрения системного анализа рынок труда...
-
Влияние давления - Химическая кинетика, равновесия, термодинамика
Существенно, прежде всего, для реакций с участием газов. Снижение давления ведет к увеличению объема и уменьшению концентраций всех газов, после чего...
Химическое равновесие - Скорость химических процессов. Химическое равновесие, принцип Ле-Шателье