Основные представления химической кинетики, Скорость химической реакции. Энергия активации химической реакции - Систематика химических элементов
Скорость химической реакции. Энергия активации химической реакции
Химическая термодинамика изучает возможность, направление и пределы самопроизвольного протекания химических процессов. Однако механизм и скорость процессов в химической термодинамике не рассматриваются. Область химии, изучающая молекулярный механизм химической реакции и скорость ее протекания, называется Химической кинетикой.
Скорость химической реакции
Различают химические реакции, протекающие в гетерогенной (гетерогенные реакции) и гомогенной (гомогенные реакции) системах.
Если реакция протекает в гомогенной системе, то она идет во всем ее объеме.
Если реакция протекает между веществами, образующими гетерогенную систему, то она может протекать только на поверхности раздела фаз.
Скоростью гомогенной реакции называется изменение количества вещества n, вступающего в реакцию или образующегося в результате реакции, за единицу времени в единице объема:
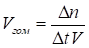
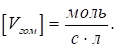
(29)
Отношение количества вещества к объему системы представляет собой молярную концентрацию, а, соответственно, приращение количества вещества - приращение молярной концентрации:
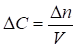
.
Тогда формула (29) принимает следующий вид:
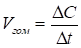
, (30)
Т. е. скоростью гомогенной реакции называется изменение концентрации какого-либо из веществ-участников реакции в единицу времени.
Скоростью гетерогенной реакции называется изменение количества вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице площади поверхности раздела фаз:
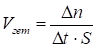
(31)

Рис. 14
Кривая 1 соответствует изменению концентрации реагентов.
Кривая 2 соответствует изменению концентрации продуктов реакции.
Энергия активации химической реакции
Для того, чтобы произошла химическая реакция, молекулы взаимодействующих веществ должны столкнуться. Не всякое столкновение молекул является эффективным, т. е. таким, чтобы произошло ослабление или разрыв связей между атомами во взаимодействующих молекулах и перегруппировка этих атомов в новые молекулы. Это происходит только в том случае, если энергия взаимодействующих молекул превышает некоторую пороговую энергию. Эта энергия получила название Энергии активации: Молекулы, обладающие энергией активации, называются Активными молекулами. Только взаимодействие активных молекул приводит к протеканию химической реакции и образованию молекул нового вещества.
Любая химическая реакция начинается с разрыва или ослабления связей между атомами в молекулах исходных веществ, при этом реагирующие между собой вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется Активированным комплексом. Именно для его образования и необходима энергия активации. Активированный комплекс существует очень короткое время и распадается с образованием продуктов реакции, энергия при этом выделяется.
В простейшем случае активированный комплекс представляет собой конфигурацию атомов, в которой ослаблены старые связи и образованы слабые новые.
Активированный комплекс возникает как промежуточное состояние, как для прямой, так и для обратной реакций. Энергетически он отличается от исходных веществ на величину энергии активации прямой реакции, от конечных веществ - на величину энергии активации обратной реакции.
Похожие статьи
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
Опис-ся правиломВант-Гоффа: С увелич-ем темп. на каждые 10 градусов. Скор. больш-ва хим. р-ций увелич-ся в 2-4 раза. Где г-темп. коэф-т скорости хим....
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Заготовьте в тетради заранее таблицу для записи исходных данных и результатов опытов. Сейчас в нее внесены некоторые предполагаемые объемы растворов, но...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим...
-
Соли-сильные электролиты, существующие в водных растворах в виде положительно запряженных ионов металлов и отрицательно заряженных ионов кислотных...
-
Основные понятия химической термодинамики - Химическая термодинамика. Термохимия. Решение задач
Прежде чем приступить к изучению предмета химической термодинамики, необходимо ввести ряд терминов и понятий, используемых в этом разделе. Изучаемые...
-
Второе начало термодинамики. Энтропия Объединенное уравнение первого и второго начал термодинамики Рис. 12 Из выражения первого начала термодинамики U =...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
(а) На основе уравнения ЗДМ объясните физический смысл константы скорости. (б) Зависит ли константа скорости от концентраций реагентов? от их природы? от...
-
Прототипом разработанной автором системы моделей служит "точечная" модель [1], представляющая собой пространственно осредненный вариант уравнений горения...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Материальный баланс производства Основанием для получения уравнения реактора любого типа является материальный баланс, составленный по одному из...
-
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
Основные представления химической кинетики, Скорость химической реакции. Энергия активации химической реакции - Систематика химических элементов