Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика
- А) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S < 0 - невозможен. когда s достигает максимума, наступает равновесие, макроскопические изменения прекращаются. типичный пример - диффузия, которая происходит без теплового эффекта: система самопроизвольно переходит в состояние с максимальной вероятностью - молекулы, атомы, ионы перемешиваются. б) там, где возможен теплообмен с окружающей средой, это уже не совсем верно. возможны экзотермические процессы с уменьшением s, например, кристаллизация жидкости, конденсация пара. поэтому первоначально был введен критерий бертло: самопроизвольно идут только экзотермические процессы, то есть процессы с уменьшением u или h. этот критерий при низких температурах оправдывается часто. действительно, потерять энергию проще, чем приобрести. простая механическая аналогия: предмет на столе имеет большую потенциальную энергию, чем на полу, скатиться и упасть на пол он может самопроизвольно, но не может сам заскочить с пола на стол. но все же и этот критерий не совсем верен. возможны и эндотермические процессы, например, испарение жидкости.
Одновременно действуют обе тенденции - и стремление к минимуму энергии (U или H), и стремление к максимуму беспорядка (S). Нужны критерии, учитывающие сразу обе тенденции. Такими критериями являются:
Энергия Гельмгольца F = U - TS для изохорно-изотермических процессов и энергия Гиббса G = H - TS = U + pV - TS = F + pV - для изобарно-изотермических.
В старой литературе их еще называют термодинамическими потенциалами (изохорно-изотермическим и изобарно-изотермическим), а также свободными энергиями Гельмгольца и Гиббса.
Тут более прямая аналогия с механической потенциальной энергией: макротела самопроизвольно скатываются в яму, к минимуму потенциальной энергии, а физико-химические системы - к минимуму термодинамического потенциала.
В изохорно-изотермических условиях самопроизвольно идут только процессы с уменьшением F: F < 0 - процесс возможен, F > 0 - процесс невозможен. Когда F достигает минимума - наступает равновесие.
Аналогично, в изобарно-изотермических условиях самопроизвольно идут только процессы с уменьшением G.
G = H - TS < 0 - условие самопроизвольного протекания процесса в изобарно-изотермических условиях. Возможны четыре варианта (рис. 5):
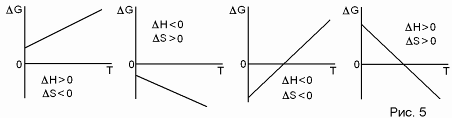
- 1) Н > 0, S < 0. при любых температурах g > 0, значит, прямой процесс невозможен. 2) Н < 0, s > 0. при любых температурах g < 0, значит, прямой процесс возможен. 3) н < 0, s < 0. возможны разные знаки g в зависимости от т.
Если Т 0, то G Н и справедлив принцип Бертло. В данном случае прямой процесс может идти, обратный - нет.
Если Т, то G - TS, и направление процесса определяется ростом энтропии. В данном случае может идти только обратный процесс.
4) Н < 0, S < 0. Случай, обратный предыдущему. Процесс идет самопроизвольно лишь при высоких температурах.
Но где граница между "низкими" и "высокими" температурами? Это зависит от соотношения H и S. Температура, при которой равновероятны прямой и обратный процессы (G = 0): Т0 = Н/S.
Ниже этой температуры равновесие смещается в сторону протекания экзотермической реакции, выше - в сторону эндотермической. В качественной форме это известно как частный вариант принципа Ле Шателье. Очевидно, что при разных знаках Н и S такой температуры не может быть.
Демонстрация: обратимое разложение NH4Cl <> NH3 + HCl и необратимое (NH4)2Сr2O7 N2 + Cr2O3 + 2H2O. Знак S очевиден по выделению газов, знак H во втором случае также очевиден - саморазогрев.
Вопрос. Как изменяются H, S и G при реакции BaCl2(p-p) + H2SO4(p-p) > BaSO4(тв.) + 2HCl(p-p) в изобарно-изотермических условиях? в изолированной системе? Процесс идет самопроизвольно, значит в изобарно-изотермических условиях G < 0. Но образование кристаллов позволяет утверждать, что S < 0. Тогда однозначно Н < 0. Будет ли Н < 0 в изолированной системе? Нет, Н = 0, т. к. нет теплообмена.
Система не может отдать тепло в окружающую среду, поэтому температура повышается. Но если процесс идет самопроизвольно, значит S > 0. Но может ли кристаллизация идти с ростом энтропии?
Кристаллизация - вряд ли, но раствор-то нагрелся, и рост его энтропии перевесил убыль энтропии от кристаллизации. Здесь G = - ТS < 0.
Для F, G и S, как и для U, H, справедлив закон Гесса.
Похожие статьи
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Энтропия. Движущее начало химических процессов - Химическая термодинамика. Термохимия. Решение задач
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: "Почему одни химические реакции...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Катализ - Химическая кинетика, равновесия, термодинамика
К изложенному в учебнике необходимо несколько уточнений и добавлений. Во-первых, реакция в присутствии катализатора идет не в одну стадию, а минимум в...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
Первое начало термодинамики. Энтальпия - Химическая кинетика, равновесия, термодинамика
Это закон сохранения энергии. Подводимая к системе теплота Q расходуется на изменение ее внутренней энергии и на совершение работы А: Q = U + А Здесь U =...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
При нагревании (подводе тепла) равновесие смещается в сторону протекания эндотермической реакции (поглощения этого тепла), а при охлаждении - в сторону...
-
Общие сведения Термодинамика - наука о превращениях энергии в различных процессах, как физических, так и химических, и о направлении процессов, о...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Второе начало термодинамики. Энтропия Из предыдущих глав мы знаем много обратимых процессов, но есть и необратимые, например: - переход тепла от горячего...
-
Фактически это следствие первого начала термодинамики, но сформулирован раньше, чем первое начало. Тепловой эффект изобарного (или изохорного) процесса...
-
Прогноз направления реакций и его экспериментальная проверка В тетради должны быть заранее выписаны необходимые константы (см. Приложение), проведены...
-
Чтобы возникла поверхность раздела фаз, нужна затрата энергии - Еа зародышеобразования. А когда новая фаза уже появилась, ее дальнейший рост идет...
-
В этой части практикума опыты качественные, без расчетов. Влияние температуры Предлагается запаянный двухколенный стеклянный сосуд, заполненный оксидом...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
Задачи и упражнения по химическому равновесию - Химическая кинетика, равновесия, термодинамика
При решении расчетных задач используйте цифровые данные из Приложения. Примеры решения подобных задач можно найти в задачнике Глинки [3, 4]. 1. От чего...
-
Выбор оптимальных условий проведения реакций - Химическая кинетика, равновесия, термодинамика
Если наша цель - получить максимальный выход продукта за определенное небольшое время, а реакция медленная и обратимая, то нужно одновременно учитывать...
-
Заготовьте в тетради заранее таблицу для записи исходных данных и результатов опытов. Сейчас в нее внесены некоторые предполагаемые объемы растворов, но...
-
Квазихимические равновесия в кристаллах - Химическая кинетика, равновесия, термодинамика
Равновесия дефектов в кристаллах тоже могут рассматриваться на основе ЗДМ. При этом в качестве реагентов могут фигурировать не только реальные частицы...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Это самый распространенный вариант. В реакции твердое+твердое, твердое+жидкость или твердое+газ продукт образуется на поверхности раздела фаз, и если он...
-
(а) На основе уравнения ЗДМ объясните физический смысл константы скорости. (б) Зависит ли константа скорости от концентраций реагентов? от их природы? от...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Это случай, наиболее похожий на гомогенную кинетику. Он реализуется, когда продукт гетерогенной реакции легко удаляется (растворяется, испаряется или...
-
Еще три следствия из закона Гесса - Химическая кинетика, равновесия, термодинамика
2. Тепловой эффект процесса равен разности между суммами теплот сгорания исходных веществ и продуктов с учетом коэффициентов в уравнении реакции. (при...
-
Влияние разбавления раствора - Химическая кинетика, равновесия, термодинамика
Это, как и в предыдущем параграфе, изменение концентрации, но не одного вещества, а одновременно всех растворенных веществ. Допустим, что объем раствора...
-
Влияние концентрации - Химическая кинетика, равновесия, термодинамика
При возрастании концентрации какого-то из веществ (исходных или продуктов) равновесие смещается в сторону его расходования, а при уменьшении концентрации...
-
Смещение равновесия Смещение равновесия - это изменение состояния равновесия (изменение равновесного соотношения количеств исходных веществ и продуктов)...
-
Влияние давления - Химическая кинетика, равновесия, термодинамика
Существенно, прежде всего, для реакций с участием газов. Снижение давления ведет к увеличению объема и уменьшению концентраций всех газов, после чего...
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
1. Какие вопросы решает химическая термодинамика? 2. Что называется термодинамической системой? Как классифицируются системы? Приведите примеры различных...
-
Демонстрационные опыты - Химическая кинетика, равновесия, термодинамика
Как и в предыдущем разделе, здесь приходится заменить практикум лекционными демонстрациями. Оба опыта основаны на растворении твердого карбоната кальция...
-
Основные понятия химической термодинамики - Химическая термодинамика. Термохимия. Решение задач
Прежде чем приступить к изучению предмета химической термодинамики, необходимо ввести ряд терминов и понятий, используемых в этом разделе. Изучаемые...
-
Гомогенные равновесия в растворах электролитов Константа ионизации (диссоциации) слабого основания на примере аммиака (запись NH3*H2O предпочтительнее,...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика