Кинетика химических реакций - Скорость химических процессов. Химическое равновесие, принцип Ле-Шателье
Общие понятия и определения. Термодинамический и кинетический критерий реакционной способности химической системы. Скорость химической реакции. Факторы, влияющие на скорость химической реакции (концентрация, температура, катализаторы, среда и др.).
Химическая кинетика - раздел химии, изучающий скорость и механизм химических превращений.
Все химические процессы, наблюдаемые в природе и осуществляемые человеком в его практической деятельности, протекают во времени с определенными скоростями.
Часто в химической системе, содержащей исходные химические вещества, могут протекать химические реакции с образованием различных конечных продуктов.
Например, из смеси углерода и водорода при определенных условиях (Р, Т, катализатор) могут быть получены альдегиды, органические кислоты, спирты и различные углеводороды. При осуществлении химического процесса стремятся проводить его так, чтобы выход какого-нибудь продукта был максимальным. Для этого надо создать такие условия, при которых скорость образования необходимого продукта будет значительно больше скоростей всех других возможных реакций.
Химическая кинетика, как и термодинамика, является теоретической базой химической технологии. Поэтому состояние и достижения науки в области кинетики и катализа в значительной степени определяют технический уровень производства в химической промышленности.
Важнейшей количественной характеристикой протекания химической реакции во времени является скорость реакции.
Скорость реакции - число элементарных актов реакции, происходящих в единицу времени в единице объема (гомогенные реакции) или на единице поверхности раздела фаз (гетерогенные реакции).
Изменение количества вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени.
V = Спрод/ = Сисх/.
Размерность: [v]=моль/с.
Сисх, так как скорость должна быть величиной положительной, а исходные вещества расходуются, то есть n<0.
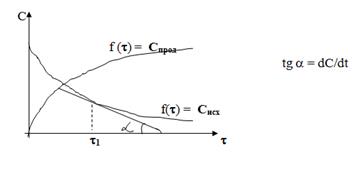
Факторы, влияющие на скорость химической реакции:
1. природа реагирующих веществ.
Факторы атомного строения
В химическом строении реагентов основным фактором является энергия разрыва наименее прочных связей, а также энергия удаления или присоединения электронов
2. концентрация реагирующих веществ.
На скорость реакции, прежде всего, влияет концентрация реагирующих веществ. химия кинетика термодинамический
Можно показать, что для реакции
А + В = АВ
Скорость реакции выражается уравнением:
V = k [А] [В],
Где k - коэффициент пропорциональности - константа скорости реакции, она не зависит от концентрации реагирующих веществ и времени.
Для реакции
АА + bВ = сС + dD
Vпр. = k [А]а [В]b Vобр. = k [С]с [D]d
Закон Гульдберга-Вааге: скорость химических реакций прямо пропорциональна произведению молярных концентраций всех реагентов, каждая из которых возведена в степень, равную коэффициенту при веществе в кинетическом уравнении реакции.
Границы применимости: для кинетических уравнений.
Для реакций с участием газов концентрация пропорциональна давлению:
C=n/V=p/(RT),
Поэтому СХР зависит и от давления;
3. температура
С повышением температуры скорость большинства реакций резко возрастает, так как быстро увеличивается число частиц с высокой энергией столкновения;
Смесь 2 Н 2 + О 2 = Н 2О
При комнатной температуре Vпр. = 0, при 1000С - идет со взрывом.
Правило Вант-Гоффа (1884):
При повышении температуры на каждые 10 градусов скорость гомогенных реакций возрастает в 2-4 раза.
Величина, показывающая, во сколько раз увеличивается скорость химической реакции при увеличении температуры на 10 0С называется Температурным коэффициентом ().
Пусть = 3, tнач = 300С, tкон = 800С,
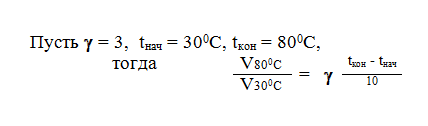
Границы правила Вант-Гоффа: для реакций с 80Еакт.160 кДж/моль.
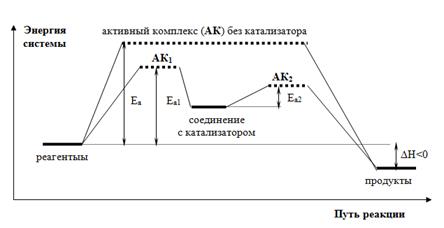
При увеличении температуры увеличивается Еакт.
Энергия активации - минимальная энергия, достаточная для осуществления акта химического взаимодействия.
Еакт. расходуется на Ослабление химических связей в молекулах исходных веществ и на преодоление взаимного отталкивания при соударении частиц.
Более выгодно через активный комплекс, т. к. затрачивается меньше энергии
Уравнение для Температурной зависимости константы скорости реакции (уравнением Аррениуса):
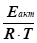
K = AeЕакт/(RT) или k = ln A.
Где е=2,718... основание натуральных логарифмов,
R газовая постоянная,
A константа, не зависящая от T.
Опыт: по взаимодействию
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + Sv.
4. скорость подвода реагентов и отвода продуктов на границе фаз гетерогенной реакции
В стационарных состояниях гетерогенные реакции обычно идут медленно, а измельчение и перемешивание сильно их ускоряет; порошки реагируют быстро, а крупные куски и монокристаллы долго;
5. присутствие в системе некоторых нерасходуемых веществ
Они могут замедлять реакцию это Ингибиторы, и ускорять реакцию Катализаторы.
Влияние катализатора сводится к снижению энергии активации. Катализатор образует нестойкие соединения с реагентами и изменяет природу лимитирующей стадии. На энергетической диаграмме показан Гомогенный катализ (реакция в газе или растворе). Процесс разбивается на 2 стадии, с энергиями активации Ea1 и Ea2 и активными комплексами АК 1 и АК 2. В случае ингибитора АК 2 лежит выше по энергии, чем АК.
Похожие статьи
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
(а) На основе уравнения ЗДМ объясните физический смысл константы скорости. (б) Зависит ли константа скорости от концентраций реагентов? от их природы? от...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
Смещение равновесия Смещение равновесия - это изменение состояния равновесия (изменение равновесного соотношения количеств исходных веществ и продуктов)...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
Выбор оптимальных условий проведения реакций - Химическая кинетика, равновесия, термодинамика
Если наша цель - получить максимальный выход продукта за определенное небольшое время, а реакция медленная и обратимая, то нужно одновременно учитывать...
-
Чтобы возникла поверхность раздела фаз, нужна затрата энергии - Еа зародышеобразования. А когда новая фаза уже появилась, ее дальнейший рост идет...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика
А) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S Одновременно действуют обе тенденции...
-
Прогноз направления реакций и его экспериментальная проверка В тетради должны быть заранее выписаны необходимые константы (см. Приложение), проведены...
-
Это случай, наиболее похожий на гомогенную кинетику. Он реализуется, когда продукт гетерогенной реакции легко удаляется (растворяется, испаряется или...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Это самый распространенный вариант. В реакции твердое+твердое, твердое+жидкость или твердое+газ продукт образуется на поверхности раздела фаз, и если он...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Катализ - Химическая кинетика, равновесия, термодинамика
К изложенному в учебнике необходимо несколько уточнений и добавлений. Во-первых, реакция в присутствии катализатора идет не в одну стадию, а минимум в...
-
Влияние разбавления раствора - Химическая кинетика, равновесия, термодинамика
Это, как и в предыдущем параграфе, изменение концентрации, но не одного вещества, а одновременно всех растворенных веществ. Допустим, что объем раствора...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них...
-
Закономерность управления процессом для реакции - Каталитический риформинг
Управлять ХТП - это означает, меняя технологические параметры процесса (температуру, давление, состав сырья, катализатор, скорость перемешивания,...
-
Заготовьте в тетради заранее таблицу для записи исходных данных и результатов опытов. Сейчас в нее внесены некоторые предполагаемые объемы растворов, но...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
Еще три следствия из закона Гесса - Химическая кинетика, равновесия, термодинамика
2. Тепловой эффект процесса равен разности между суммами теплот сгорания исходных веществ и продуктов с учетом коэффициентов в уравнении реакции. (при...
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
В этой части практикума опыты качественные, без расчетов. Влияние температуры Предлагается запаянный двухколенный стеклянный сосуд, заполненный оксидом...
-
При нагревании (подводе тепла) равновесие смещается в сторону протекания эндотермической реакции (поглощения этого тепла), а при охлаждении - в сторону...
-
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества,...
-
Принцип Ле Шателье - Систематика химических элементов
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций и минимальному значению энергии Гиббса (G0Т=0), является наиболее...
Кинетика химических реакций - Скорость химических процессов. Химическое равновесие, принцип Ле-Шателье