Условия равновесия в самопроизвольном процессе в изохорно-изотермической системе - Химическая термодинамика и ее процессы
Энергия Гельмгольца Изохорно-изотермический потенциал
F = U - TS
Величина (V - TS) является свойством системы; она называется энергией Гельмгольца. Была введена Гельмгольцем В 1882 г.
DF = dU - TdS - SdT,
U = F + TS,
DF = TdS - pdV - SdT,
F - Полный дифференциал.
Увеличение объема приводит к тому, что изохорно-изотермический потенциал уменьшается (тот "минус", который стоит перед Р ). Повышение температуры приводит к тому, что F Уменьшается.
?АРавн> ?АНеравн
Q = ?U + A,
A = Q - ?U,
A = T(S2 - S1) - (U2 - U1),
А = F1 - F2 = -?F,
АРавн= -?F -
Физический смысл изохорно-изотермического потенциала.
Убыль изохорно-изотермического потенциала равна максимальной работе, производимой системой в этом процессе; F - Критерий направленности самопроизвольного процесса в изолированной системе. Для самопроизвольного процесса: AFTг< 0.
Для несамопроизвольного процесса: FT, V> 0. Для равновесного процесса: FT, V= 0.
Изохорно-изотермический потенциал в самопроизвольных процессах уменьшается и, когда он достигает своего минимального значения, то наступает состояние равновесия
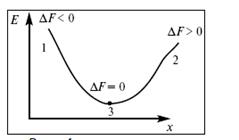
Где 1 - самопроизвольный процесс;
- 2 - несамопроизвольный процесс; 3 - равновесный процесс.
Похожие статьи
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Введение - Химическая термодинамика и ее процессы
Предметом физической химии является объяснение химических явлений на основе более общих законов физики. Физическая химия рассматривает две основные...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Ангидритным способом в лабораторных условиях Разложение фосфата серной кислотой проводим согласно уравнению реакции: Ca3(PO4)2 + 3H2SO4 > 3CaSO4(тв)...
-
Математическое моделирование экономических явлений и процессов с целью оптимизации процессов управления - область научно-практической деятельности,...
-
Модель в общем смысле (обобщенная модель) есть создаваемый с целью получения и (или) хранения информации специфический объект (в форме мысленного образа,...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
МЕТОДЫ ОПИСАНИЯ СОЦИАЛЬНО-ПОЛИТИЧЕСКИХ И ЭКОНОМИЧЕСКИХ ПРОЦЕССОВ Динамический образ системы. Системный процесс В своей повседневной жизни процессами люди...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
Прототипом разработанной автором системы моделей служит "точечная" модель [1], представляющая собой пространственно осредненный вариант уравнений горения...
-
В качестве примера конкретной модели процесса управления обсудим модель распределения времени между овладением знаниями и развитием умений, впервые...
-
Процесс получения фосфорной кислоты, не смотря на крупнотоннажность производства и довольно длительное использование в различных сферах...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Актуальность темы. В современных условиях глобальной конкуренции на все более интегрирующихся мировых рынках, развитие химической промышленности...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Модель "вход - выход" для нестационарной системы управления можно представить в следующем виде [2] . Где коэффициенты матриц возмущения и ограничены...
-
В большинстве реальных больших систем не обойтись без учета "состояний природы" -- воздействий Стохастического типа, случайных величин или случайных...
-
Рассмотрим две проблемы сравнительной оценки эффективности различных подходов к оптимизации управления экономическими системами. Сравнение по...
-
Конкретные модели процессов управления в социальных и экономических системах исходят из общей методологии, которую и формулируем в настоящей статье....
-
Программное управление является приемлемым подходом во многих прикладных ситуациях. На этом принципе основаны, например, простые металлорежущие станки...
-
Оценка устойчивости системы по переходному процессу
Определение передаточных функций разомкнутой и замкнутой системы по управляющему и возмущающему воздействию Разомкнутая САУ - система с разомкнутым...
-
В последнее десятилетие в нашей стране очень сильно возросло потребление парфюмерно-косметических товаров. На российском рынке постоянно появляются новые...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
Внутренняя энергия термодинамическая функцция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в...
-
Проблема аккуратной компьютерной имитации рабочего процесса ДВС всех типов заключается в высокой размерности модельных динамических систем, причем...
-
Моделирование системы в условиях неопределенности - Основы теории систем и системного анализа
Как уже отмечалось в первой части нашего курса, в большинстве реальных больших систем не обойтись без учета "состояний природы" -- воздействий...
-
Исследования, проводимые в последние годы, указывают на перспективность использования систем, для которых характерна фотоинициируемая валентная...
-
Элементы 4 и 8 в исходной схеме соединены последовательно. Заменяем их квазиэлементом С. В исходной схеме элементы 12 и 13 образуют параллельное...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Основные процессы СЭС представлены комплексом направлений деятельности, которые можно представить как EP(t)={EP1(t), EP2(t) ... EPN(t)},, где i=1..n, n -...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
В статье представлена структурная модель социально-экономической системы как объекта управления, функционирующего в среде быстроизменяющихся внешних и...
-
Формирование требований к информационной системе Организационная структура предприятия Организационная структура ВУЗа представлена на рисунке 1.1. Рис...
-
Химические свойства Алюминия. - Третья группа периодической системы
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1. В обычных условиях Алюминий в соединениях 3-валентен, но при...
-
Для реализации математической модели оценки состояния СЭС разработан алгоритм определения целей развития СЭС. Для разработки алгоритма необходим анализ...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Моделирование в условиях противодействия, игровые модели - Основы теории систем и системного анализа
Как уже неоднократно отмечалось, системный анализ невозможен без учета взаимодействий данной системы с внешней средой. Ранее упоминалась необходимость...
Условия равновесия в самопроизвольном процессе в изохорно-изотермической системе - Химическая термодинамика и ее процессы