ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1:
- 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите математическое выражение для скорости прямой и обратной реакции, выразив скорость через концентрации, если вещества находятся в твердой или жидкой фазе, или через парциальные давления компонентов, если вещество является газообразным. 4.1.3. Определите молекулярность и порядок реакции. 4.1.4. Запишите выражение для константы равновесия химической реакции. 4.1.5. Рассчитайте изменение скоростей прямой и обратной реакций и укажите, в какую сторону будет смещаться равновесие:
- А) при увеличении концентрации исходных веществ в 2 раза; Б) при увеличении объема всей системы в 3 раза;
В при повышении температуры.
Пример решения 4.1
Согласно своему варианту выбираем химическую реакцию с указанием величины изменения энтальпии (ДН) химической реакции. Рассмотрим две реакции:
- А) 4NH3 (г) + 3О2 (г) 2N2 (г) + 6Н2О (г) ДН < 0; б) 2so2 (г) + 2pbo (тв) 2pbs (тв) + 3о2 (г) дн > 0. 4.1.1. Реакции бывают гомогенные и гетерогенные.
Гомогенные реакции протекают во всем объеме и, как правило, в реакции участвуют жидкие или газообразные вещества.
Гетерогенные реакции протекают на границе раздела фаз, чаще всего на поверхности твердого тела.
Исходя из того, что исходными веществами в реакции а) являются газообразные вещества NH3 и О2 - данная реакция при протекании в прямом направлении является гомогенной. Если реакция протекает в обратном направлении, то взаимодействуют газообразные вещества N2 и Н2О, и данная реакция также является гомогенной.
В реакции б) для прямого направления химическое взаимодействие SO2 идет на поверхности PbO (тв), поэтому данная реакция является гетерогенной. По аналогии, если рассмотреть реакцию б) в обратном направлении, то взаимодействие О2 (г) с PbS (тв) происходит на поверхности твердой фазы - данная реакция также является гетерогенной.
4.1.2. Из закона действующих масс известно, что при постоянной температуре скорость химической реакции (V) зависит от природы вещества, выражаемой через константу скорости (k), и концентрации реагирующих веществ, возведенные в степень, равную числу молей веществ в уравнении химической реакции ([A]a).
Для газообразных веществ вместо концентраций следует использовать парциальные давления газов (Р).
Если вещества твердые, их количество при протекании реакции изменяется, однако концентрация вещества в твердой фазе сохраняется и остается равной 100 % или равной единице. Поэтому в кинетическом уравнении концентрация твердых веществ не учитывается.
Таким образом, для первой реакции а), которая является гомогенной, закон действующих масс выражается следующими уравнениями:
Для прямого направления
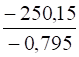
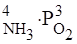
= -Р;
Для обратного направления
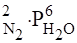
= Р.
Для реакции б), которая является гетерогенной, концентрации твердых веществ не учитываем и получаем:
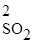
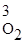
= Р; = Р.
4.1.3. Число молекул реагентов, принимающих участие в простейшей (элементарной) стадии, называется ее молекулярностью (М). Элементарный акт представлен уравнением химической реакции. Для варианта а) = 4 + 3 = 7; = 2 + 6 = 8. Для варианта б) = 2 + 2 = 4 ; = 2 + 3 = 5.
Порядок реакции показывает, как природа вещества влияет на зависимость скорости реакции от концентрации (или парциального давления) реагирующих веществ.
Порядок реакции (П) определяется суммой величин показателей степеней при значениях концентрации (парциального давления) реагирующих веществ. Порядок рассчитывается с использованием закона действующих масс. Тогда для вариантов:
- А) = 4 + 3 = 7; = 2 + 6 = 8; Б) = 2; = 3.
Следует отметить, что порядок реакции свыше 3 свидетельствует, что процесс идет сложным образом и протекает через ряд промежуточных стадий.
4.1.4. Для реакции, которая находится в состоянии равновесия, скорости прямой и обратной реакции равны: = .
Химическое равновесие выражается константой равновесия (Кравн.), связанной с отношением констант скоростей прямой и обратной реакций:
Кравн. = .
Константу равновесия следует выражать через соотношение равновесных концентраций (или парциальных давлений) конечных и начальных веществ.
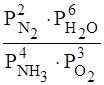
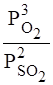
- А) Кравн. = ; б) Кравн. = . 4.1.5. А) Рассмотрим, в какую сторону смещается равновесие при увеличении концентрации или парциальных давлений исходных веществ в 2 раза.
Если в законе действующих масс для прямой реакции (п. 4.1.2) парциальное давление каждого вещества увеличить в 2 раза, то получаем, что для реакции а) возрастает в 24-23 = 27 раз; для б) - в 22 раз. Скорость обратной реакции не зависит от концентрации исходных веществ и остается постоянной. Поэтому в обоих случаях равновесие смещается в сторону конечных веществ.
Б) Если увеличить объем всей системы в 3 раза, то концентрация (или парциальное давление) каждого вещества уменьшится в 3 раза. В результате уменьшится скорость как прямой, так и обратной реакции. Для варианта а) уменьшится в 34-33 = 37, а - в 32-36 = 38 раз. Таким образом, больше окажется скорость прямой реакции и равновесие сдвигается вправо.
Для варианта б) уменьшится в 32 = 9 раз, а снизится в 33 = 27 раз. Таким образом, равновесие реакции смещается вправо.
В) Рассмотрим сдвиг равновесия при повышении температуры.
В случае а) ДН < 0, энтальпия системы уменьшается. Следовательно прямая реакция сопровождается выделением тепла и является экзотермической. Тогда обратная реакция будет эндотермической, т. е. сопровождается поглощением тепла. При нагревании ускоряется реакция, идущая с поглощением тепла, т. е. обратная. Равновесие смещается влево.
В случае б) ДН > 0. Прямая реакция протекает с поглощением тепла и является эндотермической, а обратная - экзотермической. Нагревание способствует ускорению прямой реакции, и равновесие сдвигается вправо.
Таблица IV.1
|
Номер Варианта |
Уравнение реакции | 
ДH, КДж/моль |
|
1 |
2NO (г) + O2 2NO2 (г) |
+116,9 |
|
2 |
N2 (г) + 3H2 (г) 2NH3 (г) |
-91,9 |
|
3 |
Н2 (г) + 1/2 О2 (г) Н2О (ж) |
-285,8 |
|
4 |
2Al (т) + 3/2 O2 (г) Al2O3 (т) |
-1675,8 |
|
5 |
1/2Н2 (г) + 1/2 N2 (г) + 3/2 О2 (г) = НNО3 (ж) |
-173,8 |
|
6 |
SO2 (г) + 1/2 O2 (г)SO3 (г) |
+98,0 |
|
7 |
СН4 (г) + 2О2 (г) СО2 (г) + 2Н2О (г) |
-802,3 |
|
8 |
СН4 (г) + 2Н2О (г) СО2 (г) + 4Н2 (г) |
+164,9 |
|
9 |
1/2Н2 (г) + 1/2 Br2 (г) НBr (г) |
-35,9 |
|
10 |
С3Н8 (г) + 5О2 (г) 3СО2 (г) + 4Н2О (г) |
-2043,8 |
|
11 |
С6Н12О6 (г) + 6О2 (г) 6СО2 (г) + 6Н2О (ж) |
-2816 |
|
12 |
СН3ОН (ж) СО (г) + 2Н2 (г) |
+128,1 |
|
13 |
PCl5 (г) PCl3 (г) + Cl2 (г) |
+129,6 |
|
14 |
Н2 (г) + S (т) Н2 (г) |
-41,8 |
|
15 |
2HBr (г) H2 (г) + Br2 (г) |
-70,2 |
|
16 |
Н2 (г) + S (ж) Н2S (г) |
-20,9 |
|
17 |
Fe2O3 (т) + 3H2 (г) 2Fe (т) + 3H2O (г) |
+89,6 |
|
18 |
СаО (т) + СО2 (г) СаСО3 (т) |
-178,0 |
|
19 |
СО2 (г) + С (т) 2СО (г) |
+160,1 |
|
20 |
MgCO3 (т) MgO (т) + CO2 (г) |
+117,4 |
|
21 |
2СО (г) + О2 (г) 2СО2 (г) |
-568,5 |
|
22 |
N2O4 (г) 2NO2 (г) |
+58,0 |
|
23 |
СО (г) + Н2О (г) СО2 (г) + Н2 (г) |
-41,8 |
|
24 |
С (т) + Н2О (г) СО (г) + Н2 (г) |
+117,0 |
|
25 |
N2 (г) + O2 (г) 2NO (г) |
+ 180,6 |
|
26 |
4HCl (г) + О2 (г) 2Cl2 (г) + 2Н2О (г) |
-116,4 |
|
27 |
2С (т) + 3Н2 (г) + 1/2О2 (г) С2Н5ОН (ж) |
-277,6 |
|
28 |
CS2 (ж) + 3О2 (г) СО2 (г) + 2SO2 (г) |
-1075,0 |
|
29 |
SO2 (г) + 2Н2S (г) 3S (т) + 2Н2О (ж) |
-234,5 |
|
30 |
2ZnS (т) + 3О2 (г) 2ZnO (т) + 2SO2 (г) |
-890,0 |
Похожие статьи
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
ДИСПЕРСНЫЕ СИСТЕМЫ - Неограническая химия
Задание 5.1. В определенном объеме раствора V л содержится m г вещества. Плотность раствора с (табл. V.1). Рассчитайте: 5.1.1. Процентную концентрацию...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
Возникновение структурной теории позволило химикам впервые обрести мощный инструмент для целенаправленного качественного преобразования веществ. Именно в...
-
Химия в содружестве с другими науками, дает обширный, фундаментальный материал для выработки ученого научно-философских взглядов на природу и окружающий...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Слабые (L<<1, L<<100%) нек. мин. к-ты HNO2, H3PO4, HJ NH3, все ост. органич. основания (Me(OH)2), больш-во органич. кислот НСООН, СН3СООН,...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
ОСНОВЫ ЭЛЕКТРОХИМИИ - Неограническая химия
Задание 6.1. В данной (табл. VI.1) окислительно-восстановительной реакции уравняйте стехиометрические коэффициенты ионно-электронным методом и...
-
В данном разделе речь идет об особом уровне развития химических знаний, на котором главенствующую роль играет структура молекулы реагента. Свойства...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
Структурная химия - Естественнонаучные концепции развития химических знаний
Структура - это устойчивая упорядоченность качественно неизменной системы (молекулы). Под данное определение подпадают все структуры, которые исследуются...
-
Химическая связь и строение молекул вещества. - Роль химии в повседневной жизни
Атомистические воззрения возникли первоначально на Древнем Востоке, в античных Греции и Риме. Первоначально атомное учение предполагало существование...
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
До недавнего времени об эволюционной химии ничего не было известно. В отличие от биологов, химиков не интересовал вопрос о "происхождении видов"...
-
Химия экстремальных состояний - Концепции современного естествознания: химическая составляющая
В отличие от каталитической химии, особенностью которой является химическая активизация молекул реагента, т. е. расслабление исходных химических связей...
-
От алхимии к научной химии - Естественнонаучные концепции развития химических знаний
Во второй половине ХVII в. алхимическая традиция постепенно исчерпывает себя. В течение более чем тысячи лет алхимики исходили из уверенности в...
-
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Важность представлений о Системе химии лучше всего охарактеризовал Д. И. Менделеев. "Как там ни рассуждайте и не критикуйте историю, - писал он, - а...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Новый класс металлорганических соединений, имеющий двухслойную структуру, называется "сэндвичевые соединения". Наиболее изученным из них является...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
Система химии, логика ее развития и построения Что такое химия? Химия является высокоупорядоченной - постоянно развивающейся системой знаний о веществах,...
-
Химические препараты - Химия в быту
Человек чуть ли не с рождения сталкивается с химией, точнее с химическими препаратами, которые окружают нас везде. Возьмите элементарное мытье посуды,...
-
Периодический закон химических элементов: свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической...
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Кремний - элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14....
-
К числу физических факторов, вызывающих коррозию цементного камня и бетона, относят их попеременное увлажнение и высыхание, которое сопровождается...
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия