Влияние концентрации - Химическая кинетика, равновесия, термодинамика
При возрастании концентрации какого-то из веществ (исходных или продуктов) равновесие смещается в сторону его расходования, а при уменьшении концентрации - в сторону его образования. Это непосредственно следует из закона действия масс. Если существует равновесие aA + bB = xX + yY, то справедливо равенство
[X]0X[Y]0Y / ([A]0A[B]0B) = K,
Где нижний индекс ноль соответствует равновесному состоянию. Допустим, мы растворили без изменения объема добавочное количество вещества Х, так что его концентрация стала выше, а остальные концентрации пока не изменились (момент 2 на рис. 4).
Тогда дробь стала больше константы равновесия, то есть равновесие нарушилось. Чтобы его восстановить, дробь должна уменьшиться. Ускоряется обратный процесс, реакция идет так, чтобы концентрации в числителе уменьшились, а в знаменателе увеличились. Рано или поздно дробь возвращается к исходному значению, то есть устанавливается новое равновесие с новыми концентрациями (помечены индексом 1): [X]1 > [X]0, [Y]1 < [Y]0, [A]1 > [A]0, [B]1 > [B]0.
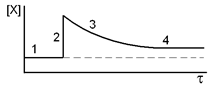
Рис. 4. Схема изменения концентрации вещества Х во времени: 1 - исходное равновесие; 2 - увеличена концентрация Х, равновесие нарушено; 3 - идет восстановление равновесия; 4 - установилось новое равновесие
Можно ли в формулировке правила заменить "возрастание концентрации вещества" на "добавление вещества"? Нет, это может привести к ошибкам. Добавка вещества не всегда ведет к возрастанию его концентрации. Если вещество составляет отдельную твердую или жидкую фазу, то его концентрация постоянна и не подставляется в выражение закона действия масс, а автоматически учитывается в величине К. Поэтому добавка новых кусков твердой фазы не меняет концентраций и не смещает равновесия. Но даже если вещество растворимо, то не всякая его добавка ведет к росту его концентрации. Пример из практикума.
Студент: Что-то у меня реакция не идет.
Преподаватель: Там нужна высокая концентрация кислоты; добавьте еще.
Студент подливает из банки с надписью 0,1 М HCl. Естественно, от этого концентрация кислоты скорее понизится, т. к. в исходной смеси она, вероятно, была выше 0,1 М.
Похожие статьи
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
Гомогенные равновесия в растворах электролитов Константа ионизации (диссоциации) слабого основания на примере аммиака (запись NH3*H2O предпочтительнее,...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
Смещение равновесия Смещение равновесия - это изменение состояния равновесия (изменение равновесного соотношения количеств исходных веществ и продуктов)...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
Заготовьте в тетради заранее таблицу для записи исходных данных и результатов опытов. Сейчас в нее внесены некоторые предполагаемые объемы растворов, но...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Катализ - Химическая кинетика, равновесия, термодинамика
К изложенному в учебнике необходимо несколько уточнений и добавлений. Во-первых, реакция в присутствии катализатора идет не в одну стадию, а минимум в...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Это случай, наиболее похожий на гомогенную кинетику. Он реализуется, когда продукт гетерогенной реакции легко удаляется (растворяется, испаряется или...
-
(а) На основе уравнения ЗДМ объясните физический смысл константы скорости. (б) Зависит ли константа скорости от концентраций реагентов? от их природы? от...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Чтобы возникла поверхность раздела фаз, нужна затрата энергии - Еа зародышеобразования. А когда новая фаза уже появилась, ее дальнейший рост идет...
-
Демонстрационные опыты - Химическая кинетика, равновесия, термодинамика
Как и в предыдущем разделе, здесь приходится заменить практикум лекционными демонстрациями. Оба опыта основаны на растворении твердого карбоната кальция...
-
Это самый распространенный вариант. В реакции твердое+твердое, твердое+жидкость или твердое+газ продукт образуется на поверхности раздела фаз, и если он...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
Квазихимические равновесия в кристаллах - Химическая кинетика, равновесия, термодинамика
Равновесия дефектов в кристаллах тоже могут рассматриваться на основе ЗДМ. При этом в качестве реагентов могут фигурировать не только реальные частицы...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
Моющие вещества (МВ) составляют основу всех СМС и определяют их свойства; это мицеллообразующие поверхностно-активные вещества, благодаря которым...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
ТЕРМОХИМИЯ - Химическая термодинамика. Термохимия. Решение задач
Уравнения химических реакций, учитывающие тепловые эффекты, называются термохимическими уравнениями. Например: 2Н2(г.)+О2(г.) = 2Н2О(г.); ДН = - 476 кДж....
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Введение - Химическая термодинамика. Термохимия. Решение задач
Химия изучает химическую форму движения материи, под которой понимают превращение одних веществ в другие. В результате химических процессов появляются...
-
В последнее десятилетие в нашей стране очень сильно возросло потребление парфюмерно-косметических товаров. На российском рынке постоянно появляются новые...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
Энтропия. Движущее начало химических процессов - Химическая термодинамика. Термохимия. Решение задач
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: "Почему одни химические реакции...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Основные понятия химической термодинамики - Химическая термодинамика. Термохимия. Решение задач
Прежде чем приступить к изучению предмета химической термодинамики, необходимо ввести ряд терминов и понятий, используемых в этом разделе. Изучаемые...
-
Введение - Химическая термодинамика и ее процессы
Предметом физической химии является объяснение химических явлений на основе более общих законов физики. Физическая химия рассматривает две основные...
-
Химическая термодинамика. Термохимия. Решение задач
> Стандартные энтальпии образования Н298, энтропии Sє298 и энергии Гиббса образования ДG298 некоторых веществ Вещество Н298, кДж/моль Sє298, Дж/(моль-К)...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
Влияние концентрации - Химическая кинетика, равновесия, термодинамика