Электрохимические процессы, Электродный потенциал - Систематика химических элементов
Электродный потенциал
Электрохимические процессы - Это процессы взаимного превращения химической и электрической форм энергии.
Их можно разделить на две группы:
- 1. Процессы превращения химической энергии в электрическую (гальванический элемент). 2. Процессы превращения электрической энергии в химическую (электролиз).
Электрохимическая система состоит из двух электродов и ионного проводника между ними.
Электродами называются проводники, имеющие электронную проводимость; это так называемые Проводники первого рода.
Ионным проводником, т. е. Проводником второго рода, служат растворы или расплавы электролитов, а также твердые растворы.
Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, который называют Внешней цепью электрохимической системы.
Рассмотрим процессы, протекающие при погружении металлов в раствор собственных ионов.
В узлах кристаллической решетки металла расположены катионы, находящиеся в равновесии со свободными электронами.
Ме+ - з Ме+ + з.
При погружении металла в водный раствор начинается взаимодействие поверхностных катионов с полярными молекулами воды, ориентированными у поверхности электрода. В результате этого взаимодействия происходит окисление металла, его ионы переходят в раствор, гидратируются, а в металле остаются электроны, заряд которых не скомпенсирован положительно заряженными ионами:
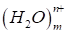
Ме + mH2 О > Me + nз.
Поверхность металла становится заряженной отрицательно, а раствор - положительно. Положительные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. В результате на границе раздела металл - раствор возникает двойной электрический слой. Между металлом и раствором возникает разность (скачок) потенциалов, которая называется Электродным потенциалом.
По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и соответственно положительный заряд раствора, что препятствует дальнейшему окислению металла.
Наряду с этой реакцией происходит и обратная реакция, т. е. восстановление ионов металла до атомов
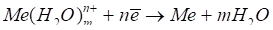
.
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость прямой реакции станет равной скорости обратной реакции, т. е. установится равновесие.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется Равновесным электродным потенциалом.
Абсолютное значение равновесного электродного потенциала экспериментально определить невозможно, можно определить только разность электродных потенциалов. Поэтому находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимается равным нулю.
Похожие статьи
-
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов...
-
Термодинамика растворения. Растворение газов в жидкостях. Закон Генри. Давление пара растворов. Закон Рауля Молекулярным (истинным) раствором называется...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
Принцип Ле Шателье - Систематика химических элементов
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций и минимальному значению энергии Гиббса (G0Т=0), является наиболее...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
Гальванический элемент. ЭДС гальванического элемента - Основы химии
Рассмотрим простейший гальванический элемент Даниэля - Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы...
-
Фазовое равновесие. Правило фаз. Диаграмма состояния однокомпонентной системы Гетерогенные равновесия, связанные с переходом веществ из одной фазы в...
-
Второе начало термодинамики. Энтропия Объединенное уравнение первого и второго начал термодинамики Рис. 12 Из выражения первого начала термодинамики U =...
-
Ионное произведение. Водородный показатель Электропроводность воды объясняется тем, что вода в очень малой степени диссоциирует, образуя ионы водорода и...
-
Растворы электролитов. Степень электрической диссоциации. Слабые электролиты. Константа диссоциации Растворы электролитов. Степень электрической...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
Гомогенный и гетерогенный катализ - Систематика химических элементов
Вещества, увеличивающие скорость химической реакции, называются Катализаторами. Явление возрастания скорости реакции под действием таких веществ,...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
Кипение и замерзание растворов - Систематика химических элементов
Следствием снижения давления насыщенного пара растворителя над раствором является повышение температуры кипения по сравнению с чистым растворителем и...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Химические свойства Магния. - Химический элемент Магний
Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина,...
-
Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика
А) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S Одновременно действуют обе тенденции...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
Энтропия. Движущее начало химических процессов - Химическая термодинамика. Термохимия. Решение задач
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: "Почему одни химические реакции...
-
Коррозия - это самопроизвольный процесс разрушения металлов и сплавов в результате окислительно-восстановительного (химического, электрохимического и...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
Электрохимические процессы, Электродный потенциал - Систематика химических элементов