Математическая формулировка объединенного закона термодинамики - Химическая термодинамика и ее процессы
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально обнаруженных объективных закономерностях, выраженных в двух основных началах термодинамики.
Термодинамика изучает:
- 1. Переходы энергии из одной формы в другую, от одной части системы к другой; 2. Энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов; 3. Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях.
Термодинамика не рассматривает внутреннее строение тел и механизм протекающих в них процессов;
- 2. Классическая термодинамика изучает только макроскопические системы; 3. В термодинамике отсутствует понятие "время".
В этом реферате мы будем говорить о первом начале термодинамики.
Этот закон обобщает закон превращения и сохранения энергии для термодинамической системы. Говорит он о том, что изменение внутренней энергии термодинамической системы, которая является неизолированной, будет равно разности количества теплоты, передаваемой системе, и работы, совершаемой системой над внешними объектами. Количество теплоты, которое получает система, идет на изменение внутренней ее энергии и совершение ею работы над внешними объектами. Рассмотрим этот закон термодинамики применительно к изопроцессам газов.
При изохорном процессе газ работу не совершает. Значит количество теплоты, передаваемое системе, будет равняться изменению внутренней энергии. То есть, при изохорном нагревании, тепло будет поглощаться газом и, соответственно, будет увеличиваться его внутренняя энергия. При охлаждении, тепло будет отдаваться внешним телам.
При изобарном расширении, тепло газом поглощается, и он совершает работу положительную. При изобарном сжатии, температура газа уменьшается, тепло отдается внешним объектам, внутренняя энергия при этом убывает.
При изотермическом процессе, изменения температуры газа не происходит, следовательно, не происходит и изменения внутренней энергии. В процессе изотермического расширения количество теплоты, которую получает газ, превращается в работу над внешними объектами. Работа внешних сил, которая производится газом, при изотермическом сжатии превращается в тепло, передающееся окружающим телам.
Адиабатические процессы - это процессы сжатия или расширения газа в адиабатических оболочках. Такими оболочками называют сосуды, в которых отсутствует теплообмен с окружающими объектами. Так как в этом процессе теплота равна нулю, то учитывая законы термодинамики, в частности первый закон, получается, что газ будет совершать работу за счет убыли своей внутренней энергии. Для адиабатического процесса идеального газа, в термодинамике выводится уравнение, которое называется уравнением Пуассона.
Первый закон термодинамики представляет собой обобщение опытных факторов. Согласно ему, энергия не может создаваться или уничтожаться, она будет передаваться от системы к системе и превращаться из одной формы в другую.
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ДU:
Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.
- (I.1) (I.2)
Уравнение (I.1) является математической записью 1-го начала термодинамики для конечного, уравнение (I.2) - для бесконечно малого изменения состояния системы.
Рассмотрим приложение первого начала термодинамики для определения работы, совершаемой системой при различных термодинамических процессах (мы будем рассматривать простейший случай - работу расширения идеального газа).
Изохорный процесс (V = const; ДV = 0).
Поскольку работа расширения равна произведению давления и изменения объема, для изохорного процесса получаем:
- (I.1) (I.4) (I.5)
Изотермический процесс (Т = const).
Из уравнения состояния одного моля идеального газа получаем:
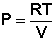
(I.6)
Отсюда:
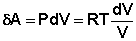
(I.7)
Проинтегрировав выражение (I.6) от V1 до V2, получим
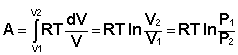
(I.8)
Изобарный процесс (Р = const).
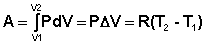
(I.9)
Подставляя полученные выражения для работы различных процессов в уравнение (I.1), для тепловых эффектов этих процессов получим:
(I.10)
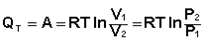
- (I.11) (I.12)
В уравнении (I.12) сгруппируем переменные с одинаковыми индексами. Получаем:
(I.13)
Введем новую функцию состояния системы - энтальпию H, тождественно равную сумме внутренней энергии и произведения давления на объем:
Тогда выражение (I.13) преобразуется к следующему виду:
(I.14)
Т. о., тепловой эффект изобарного процесса равен изменению энтальпии системы.
Адиабатический процесс (Q = 0).
При адиабатическом процессе работа расширения совершается за счет уменьшения внутренней энергии газа:
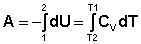
(I.15)
В случае если CV не зависит от температуры (что справедливо для многих реальных газов), работа, произведенная газом при его адиабатическом расширении, прямо пропорциональна разности температур:
(I.16)
Первый закон термодинамики представляет собой обобщение опытных факторов. Согласно ему, энергия не может создаваться или уничтожаться, она будет передаваться от системы к системе и превращаться из одной формы в другую.
Равновесный процесс
Протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG < 0, dF < 0). Очевидно, что рано или поздно (напомним, что понятие "время" в термодинамике отсутствует) система достигнет минимума свободной энергии. Условием минимума некоторой функции Y = f(x) является равенство нулю первой производной и положительный знак второй производной: dY = 0; d2Y > 0. Таким образом, Условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала:
Изобарно-изотермические (P = const, T = const):
ДG = 0 dG = 0, d2G > 0
Изохорно-изотермические (V = const, T = const):
ДF = 0 dF = 0, d2F > 0
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Учение о равновесных состояниях - один из разделов термодинамики. Мы будем рассматривать частный случай термодинамического равновесного состояния - химическое равновесие. Как известно, многие химические реакции являются обратимыми, т. е. могут одновременно протекать в обоих направлениях - прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия - концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является Динамическим, т. е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является Подвижным - всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Еще одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне.
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации - С, парциальные давления - P или мольные доли - X реагирующих веществ. Для некоторой реакции
Соответствующие константы равновесия выражаются следующим образом:
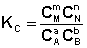
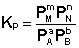
(I.78) (I.79)
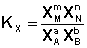
(I.80)
Константа равновесия есть характерная величина для каждой обратимой химической реакции; Величина константы равновесия зависит только от природы реагирующих веществ и температуры. Выражение для константы равновесия для элементарной обратимой реакции может быть выведено из кинетических представлений.
Теперь рассмотрим более строгий термодинамический вывод выражения для константы равновесия. Для этого необходимо ввести понятие Химический потенциал. Очевидно, что величина свободной энергии системы будет зависеть как от внешних условий (T, P или V), так и от природы и количества веществ, составляющих систему. В случае, если состав системы изменяется во времени (т. е. в системе протекает химическая реакция), необходимо учесть влияние изменения состава на величину свободной энергии системы. Введем в некоторую систему бесконечно малое количество dnI молей i-го компонента; это вызовет бесконечно малое изменение термодинамического потенциала системы. Отношение бесконечно малого изменения величины свободной энергии системы к бесконечно малому количеству компонента, внесенному в систему, есть химический потенциал мI данного компонента в системе:
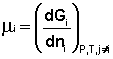
(I.85)
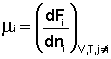
(I.86)
Химический потенциал компонента связан с его парциальным давлением или концентрацией следующими соотношениями:
- (I.87) (I.88)
Здесь м°I - стандартный химический потенциал компонента (PI = 1 атм., СI = 1 моль/л.). Очевидно, что изменение свободной энергии системы можно связать с изменением состава системы следующим образом:
- (I.89) (I.90)
Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), можно записать:
(I.91)
В закрытой системе изменение числа молей одного компонента сопровождается эквивалентным изменением числа молей остальных компонентов; т. е., для приведенной выше химической реакции имеет место соотношение:
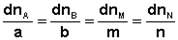
(I.92)
Отсюда можно получить следующее условие химического равновесия в закрытой системе:
(I.93)
В общем виде условие химического равновесия можно записать следующим образом:
(I.94)
Выражение (I.94) носит название уравнения Гиббса - Дюгема. Подставив в него зависимость химического потенциала от концентрации, получаем:
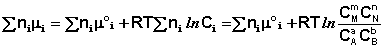
(I.95)
Поскольку УnIМI = ДF, а УnIМ°I = ДF°, получаем:
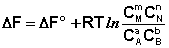
(I.96)
Для изобарно-изотермического процесса аналогичным образом можно получить:
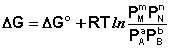
(I.97)
Полученные нами выражения I.96 - I.97 есть Изотерма химической Реакции. Если система находится в состоянии химического равновесия, то изменение термодинамического потенциала равно нулю; получаем:
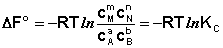
(I.98)
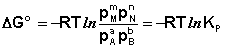
(I.99)
Здесь СI и РI - Равновесные концентрации и парциальные давления исходных веществ и продуктов реакции (в отличие от неравновесных СI и РI в уравнениях I.96 - I.97).
Поскольку для каждой химической реакции стандартное изменение термодинамического потенциала ДF° и ДG° есть строго определенная величина, то произведение равновесных парциальных давлений (концентраций), возведенных в степень, равную стехиометрическому коэффициенту при данном веществе в уравнении химической реакции (стехиометрические коэффициенты при исходных веществах принято считать отрицательными) есть некоторая константа, называемая константой равновесия. Уравнения (I.98, I.99) показывают связь константы равновесия со стандартным изменением свободной энергии в ходе реакции. Уравнение изотермы химической реакции связывает величины реальных концентраций (давлений) реагентов в системе, стандартного изменения термодинамического потенциала в ходе реакции и изменения термодинамического потенциала при переходе из данного состояния системы в равновесное. Знак ДG (ДF) определяет возможность самопроизвольного протекания процесса в системе. При этом ДG° (ДF°) равно изменению свободной энергии системы при переходе из стандартного состояния (PI = 1 атм., СI = 1 моль/л) в равновесное. Уравнение изотермы химической реакции позволяет рассчитать величину ДG (ДF) при переходе из любого состояния системы в равновесное, т. е. ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях СI (давлениях РI) реагентов:
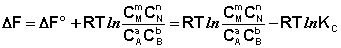
(I.100)
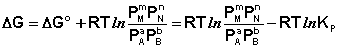
(I.101)
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если изменить эти условия (т. е. оказать на систему какое-либо внешнее воздействие), равновесие нарушается; в системе возникает самопроизвольный процесс, который продолжается до тех пор, пока система опять не достигнет состояния равновесия (уже при новых условиях). Рассмотрим, как влияют на положение равновесия некоторые факторы.
Похожие статьи
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Введение - Химическая термодинамика и ее процессы
Предметом физической химии является объяснение химических явлений на основе более общих законов физики. Физическая химия рассматривает две основные...
-
Внутренняя энергия термодинамическая функцция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в...
-
Известно, что проблема замены старого парка машин новыми, устаревших орудий -- современными -- одна из основных проблем индустрии. Оборудование со...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
Как известно, человечество в своем стремительном развитии старается все более расширить сферы своей деятельности, сталкиваясь при этом с множеством новых...
-
Прототипом разработанной автором системы моделей служит "точечная" модель [1], представляющая собой пространственно осредненный вариант уравнений горения...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Учение о химических процессах - это область науки, в которой существует наиболее глубокое взаимопроникновение физики, химии и биологии. На этом уровне...
-
Математическое моделирование экономических явлений и процессов с целью оптимизации процессов управления - область научно-практической деятельности,...
-
Изучив основные вопросы, связанные с календарным планированием, подведем итог. Задачи календарного планирования отражают процесс распределения во времени...
-
Пусть есть математическое ожидание цены состояния объекта при условии, что в момент времени tдопустимое экологическое состояние не достигнуто и цена...
-
Математическое моделирование процесса запаздывания нарастания мощности автономного источника энергии от мощности потребителя Сегодня существует...
-
Понятие квантовой химии - Квантовые концепции в химии
Квантовая химия - это раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействие и превращение в химических...
-
Теоретическое обоснование математического моделирования - Математические методы и модели в экономике
Коммерческая деятельность в том или ином виде сводится к решению таких задач: как распорядиться имеющимися ресурсами для достижения наибольшей выгоды или...
-
Уровень науки и техники Надежность средств, с помощью которых человек достигает космоса высокая, но не идеальна. РН -- сложная конструкция, и даже в...
-
Подобно предыдущему обозначим. Тогда аналогичные рассуждения приводят к соотношению . (1.10) Проделывая те же преобразования, что и при выводе уравнения...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
КОЛЛОИДНЫЕ ВЕЩЕСТВА ПРИРОДНЫХ ВОД И ИХ УДАЛЕНИЕ - Химические свойства и строение воды
Очистка сточных вод -- лишь одно из направлений защиты гидросферы, прежде всего, поверхностных вод от антропогенных загрязнений. Главный путь защиты...
-
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них...
-
Исходные данные для расчета реакторов - Проектирование химического реактора идеального смешения
При выборе конструкции и определении размеров реактора необходимо принимать во внимание различные факторы и, прежде всего, располагать данными о скорости...
-
Математическое моделирование - Основы научных исследований
Выше уже указывалось, что Математическое моделирование - это получение решений уравнений, составляющих математическую модель объекта, при изменении...
-
Введение - Проектирование химического реактора идеального смешения
Промышленный химический процесс - это экономически и экологически целесообразное производство требуемого продукта из исходного сырья....
-
Уравнение динамики теплообменника: Передаточные функции объекта получим по его уравнению динамики. Для этого запишем уравнение по заданному каналу. Затем...
-
РОЛЬ КАТАЛИЗА В ЭКОЛОГИИ - Процесс катализа
Огромную роль призван сыграть катализ в решении актуальнейшей проблемы - охраны окружающей среды. По словам Кусто, земной шар напоминает "одиноко...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Классификация математических моделей - Построение и классификация математических моделей
К классификации математических моделей разные авторы подходят по-своему, положив в основу классификации различные принципы. Можно классифицировать...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
В 1974г. группа аргентинских ученых во главе с профессором А. Эррерой получила предварительные результаты работы над латиноамериканской моделью...
-
Химия экстремальных состояний - Концепции современного естествознания: химическая составляющая
В отличие от каталитической химии, особенностью которой является химическая активизация молекул реагента, т. е. расслабление исходных химических связей...
Математическая формулировка объединенного закона термодинамики - Химическая термодинамика и ее процессы