Кинетические представления о химическом равновесии, Необратимые и обратимые реакции. Химическое равновесие - Систематика химических элементов
Необратимые и обратимые реакции. Химическое равновесие
Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают Необратимой, протекающей до конца.
К необратимым принято относить взаимодействия между веществами, в результате которых образуются осадки, газы и малодиссоциирующие вещества.
Множество химических реакций протекает Обратимо. Их особенность состоит в том, что они не идут до конца, в системе всегда остается каждое из исходных веществ.
Реакцию, протекающую вправо, называют Прямой, а влево - Обратной. Если в системе скорость прямой реакции равна скорости обратной реакции, состояние системы называется Химическим равновесием. Таким образом, кинетически условием химического равновесия является равенство
. (35)
Если равенство (35) является кинетическим условием равновесия, то равенство (G)р, т=0 - термодинамическим условием химического равновесия. Если (G)р, т =0, скорость прямой реакции при данных р и Т равна скорости обратной реакции. Неравенству(G)р, т <0 отвечает неравенство, при этом самопроизвольно идет прямая реакция и в системе накапливаются продукты реакции. Наоборот, когда (G)р, т >0. скорость обратной реакции больше, чем прямой: . Самопроизвольно при этом идет обратный процесс, и концентрация продуктов реакции в системе понижается.
Химическое равновесие характеризуется постоянным и вполне определенным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется Константой равновесия химической реакции и обозначается КC.
Для обратимой реакции, протекающей в гомогенной системе (где все вещества жидкости или газы),
Константа равновесия имеет вид

. (36)
Выражение (36) является записью Закона действующих масс Для обратимых реакций. Его можно вывести исходя из кинетических представлений:
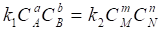
(37)
Или
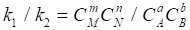
.
С учетом (36) получим
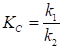
. (38)
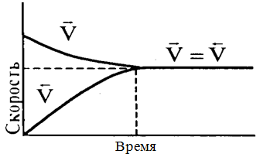
Рис. 15
При заданной температуре константа равновесия химической реакции равна отношению констант скоростей прямого и обратного процессов. Константа равновесия так же, как и константы скоростей k1 и k2, зависит от природы реагентов, температуры и не зависит от исход исходных концентраций в системе.
Концентрации газообразных веществ в выражении (36) могут быть сменены равновесными парциальными давлениями этих веществ:
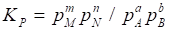
. (39)
Если обратимая реакция протекает в гетерогенной системе, то константа равновесия Кр равна отношению равновесных парциальных давлений газообразных веществ и не зависит от абсолютного и относительного количеста веществ, находящихся в конденсированном виде.
Похожие статьи
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Прогноз направления реакций и его экспериментальная проверка В тетради должны быть заранее выписаны необходимые константы (см. Приложение), проведены...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
(а) На основе уравнения ЗДМ объясните физический смысл константы скорости. (б) Зависит ли константа скорости от концентраций реагентов? от их природы? от...
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
Выбор оптимальных условий проведения реакций - Химическая кинетика, равновесия, термодинамика
Если наша цель - получить максимальный выход продукта за определенное небольшое время, а реакция медленная и обратимая, то нужно одновременно учитывать...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
Катализ - Химическая кинетика, равновесия, термодинамика
К изложенному в учебнике необходимо несколько уточнений и добавлений. Во-первых, реакция в присутствии катализатора идет не в одну стадию, а минимум в...
-
При нагревании (подводе тепла) равновесие смещается в сторону протекания эндотермической реакции (поглощения этого тепла), а при охлаждении - в сторону...
-
Влияние разбавления раствора - Химическая кинетика, равновесия, термодинамика
Это, как и в предыдущем параграфе, изменение концентрации, но не одного вещества, а одновременно всех растворенных веществ. Допустим, что объем раствора...
-
Влияние концентрации - Химическая кинетика, равновесия, термодинамика
При возрастании концентрации какого-то из веществ (исходных или продуктов) равновесие смещается в сторону его расходования, а при уменьшении концентрации...
-
Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика
А) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S Одновременно действуют обе тенденции...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
Задачи и упражнения по химическому равновесию - Химическая кинетика, равновесия, термодинамика
При решении расчетных задач используйте цифровые данные из Приложения. Примеры решения подобных задач можно найти в задачнике Глинки [3, 4]. 1. От чего...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Это случай, наиболее похожий на гомогенную кинетику. Он реализуется, когда продукт гетерогенной реакции легко удаляется (растворяется, испаряется или...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Гомогенные равновесия в растворах электролитов Константа ионизации (диссоциации) слабого основания на примере аммиака (запись NH3*H2O предпочтительнее,...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
Чтобы возникла поверхность раздела фаз, нужна затрата энергии - Еа зародышеобразования. А когда новая фаза уже появилась, ее дальнейший рост идет...
Кинетические представления о химическом равновесии, Необратимые и обратимые реакции. Химическое равновесие - Систематика химических элементов