Денатурація ферменту, Визначення амілолітичної (декстринуючої) активності - Вплив температури на активність амілаз
Температура, при якій фермент має максимальну активність, називається оптимальною температурою ферменту. Інтерес представляють дані про вплив на швидкість ферментативної реакції низьких температур. Зниження температури нижче оптимальної тимчасово сповільнює активність ферменту в силу зменшення швидкості дифузії молекул. Коли ж температуру знов підняти до оптимальної величини - активність ферменту і швидкість реакції відновиться.
Графічна залежність швидкості більшості ферментативних реакцій від температури має дзвіноподібну форму.

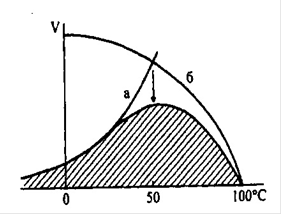
Вплив температури на швидкість реакції, яка каталізується ферментом: а - підвищення швидкості реакції як функція температури; б - зниження швидкості реакції як функція денатурації білку - ферменту; - стрілка вказує на оптимум температури.
Визначення амілолітичної (декстринуючої) активності
Амілази каналізують гідроліз високомолекулярних полісахаридів крохмалю і глікогену. Найважливішим джерелом амілаз є злакові, які містять їх як у не пророщеному, так і пророщеному зерні. В останньому випадку амілази проявляють високу активність.
Широко застосовуються амілази у крохмале-патоковому, спиртовому. Пивоварному і хлібопекарському виробництвах як головні ферменти, що каналізують процеси розщеплення крохмалю й утворення цукрі, що можуть зброджуватись.
Амілолітичну активність характеризує здатність ферментів каталізувати гідроліз крохмалю до декстринів, які не забарвлюються йодом.
Метод характеризує активність б - амілази, але при наявності в препараті в - амілази і глюкоамілази цим методом визначають сумарну дую всіх амілолитичних ферментів.
За одиницю амілолітичної активності прийнято таку кількість ферменту, що каталізує розщеплення 1 г розчиненого крохмалю до декстринів, які не забарвлюються йодом, за 1 год при температурі 30°С у чітко визначених умовах. Амілолітичну здатність (АЗ) препарату виражають числом указаних одиниць в 1 г сухого препарату чи в 1 мл розчину. При такому способі вираження АЗ безпосередньо показує скільки грамів крохмалю може бути прогудролізовано до нездатних забарвлюватись йодом декстринів 1 г препарату, культури чи 1 мл розчину за 1 год.
Мета роботи: засвоїти методику визначення амілолітичої здатності ферментного препарату.
Принцип методу грунтується на гідролізу 1,0 %-го буферного розчину крохмалю під впливом амілолитичних ферментів. Кінець реакції контролюють візуально за йодною пробою. За часом, протягом якого проходить розщеплення крохмалю до продуктів, що не забарвлюються йодом, визначається амілолітична активність препарату.
Хід роботи. У конічну колбу місткістю 50- 100 мл вносять піпеткою 20 мл 1,0 %-го розчину крохмалю і занурюють у водяну баню з температурою 30 °С (±0,2°С). Загальний об'єм реакційної суміші завжди має дорівнювати 30 мл, і якщо на аналіз беруть менше 10 мл ферментного розчину. То об'єм, якого не достає, доповнюють дистильованою водою, яку приливають перед додаванням ферментного розчину.
Через 10хв витримування в бані у колбу вносять ферментний розчин при ретельному перемішуванні і точно за секундоміром відмічають час. За початок реакції беруть час, коли з піпетки виллється половина вмісту. Через кожну хвилину після початку реакції скляною паличкою відбирають краплину рідини і на білій порцеляновій пластинці з'єднують її з раніше нанесеною краплиною робочого розчину йоду.
Реакція розщеплення крохмалю вважається закінченою, коли йод перестане давати зміну забарвлення при з'єднанні з краплиною дослідної рідини (протягом перших 10с).
Час, за який проходить розщеплення крохмалю до продуктів, що не забарвлюються йодом, може становити від 3 до 20 хв, але надійніші результати отримують у межах від 5 до 15 хв.
Примітка. Якщо час зникнення забарвлення менше 3 хв, то визначення повторюють з меншою кількістю розчину фермента, наприклад - 2 мл. У цьому разі в пробірку чи колбу з 20 мл крохмалю вносять 8 мл дистильованої води. Під час аналізу дуже активних препаратів концентрації розчинів роблять меншими (0,1 г в 200 або 500 мл).
Якщо час зникнення забарвлення становить більше 20 хв, то готують розчин більшої концентрації, наприклад 1:50 чи 1:100, а рідину можна не розбавляти зовсім.
У разі зникнення забарвлення в межах 3-5 хв проби відбирають кожні 15 с; 5 - 10 хв - кожні 30 с, а понад 10 хв - кожну хвилину.
Скляну паличку після кожної проби промивають дистильованою водою і витирають чистим некрохмаленим рушником.
Похожие статьи
-
Визначення амілолітичної (декстринуючої) активності - Вплив температури на амілолітичну активність
Амілази каналізують гідроліз високомолекулярних полісахаридів крохмалю і глікогену. Найважливішим джерелом амілаз є злакові, які містять їх як у не...
-
Опис впливу температури на активність ферменту - Вплив температури на амілолітичну активність
Однією з характерних властивостей ферментів є їх термолабільність, тобто чутливість до змін температури. У відповідності до закону Вант-Гофа, швидкість...
-
При приготуванні дріжджового тіста дріжджі розкладають крохмаль з допомогою амілази до ди - і трисахаридів, які потім використовуються у життєвій...
-
Оскільки температура має найбільш суттєвий вплив на біологічну активність ферментів, то на першому етапі роботи було досліджено вплив температур на...
-
Літературний огляд, Властивості ферментів - Вплив температури на амілолітичну активність
Властивості ферментів Ферменти - термолабільні сполуки. Це означає, що під дією високих температур вони денатурують. Спочатку при підвищенні температури...
-
Характеристика амілаз - Вплив температури на амілолітичну активність
Амілаза (діастаза) -- фермент, що гідролітично розщеплює крохмаль і глікоген з утворенням декстринів, мальтози і глюкози. Б - Амілаза є кальцій -...
-
Характеристика амілаз - Вплив температури на активність амілаз
Амілаза (діастаза) -- фермент, що гідролітично розщеплює крохмаль і глікоген з утворенням декстринів, мальтози і глюкози. Б - Амілаза є кальцій -...
-
Отримання крохмалю - Вплив температури на активність амілаз
Крохмаль одержують з картоплі і рису, рідше -- з інших зернових. Саго -- крохмалистий продукт з деревини сагової пальми, а також деяких саговників. У...
-
Вступ - Вплив температури на амілолітичну активність
Хімічні процеси, що відбуваються в живому організмі, прискорюються специфічними каталізаторами - ферменти, або ензими. З ферментами людина знайома дуже...
-
Біологічні властивості - Вплив температури на активність амілаз
Найбагатше крохмалем зерно злакових рослин: рису (до 86%), пшениці (до 75%), кукурудзи (до 72%), а також бульби картоплі (до 24%) та зерно ячменю. Для...
-
Крохмаль - Вплив температури на амілолітичну активність
Крохмаль, (С6Н10О5) n -- рослинний високомолекулярний полісахарид амілози і амілопектину, мономером яких є глюкоза. Нагромаджується в результаті...
-
Залежність крекінг-процесу від температури - Алкани як паливо. Октанове та цетанове число
Подібно до того, як було спростовано уявлення про вплив фазового стану на крекінг-процес, при подальшій роботі було вияснено, що й інші параметри, нібито...
-
Залежність крекінг-процесу від температури - Алкани як паливо
Подібно до того, як було спростовано уявлення про вплив фазового стану на крекінг - процес, при подальшій роботі було вияснено, що й інші параметри,...
-
Визначення лужності води - Питні мінеральні води
Під загальною лужністю води розуміють суму аніонів OH-, CO32-, HCO3-, що містяться у воді. Одночасно всі аніони існувати не можуть внаслідок протікання...
-
Методи визначення кальцію, Методи розділення - Питні мінеральні води
Для визначення кальцію часто доводиться попередньо видаляти всі елементи, крім лужних і лужноземельних. Методи розділення Електроліз із ртутним катодом....
-
Высокая каталитическая эффективность. Отличительной особенностью любого фермента является его чрезвычайно высокая каталитическая эффективность. Так,...
-
Застосування кислотно-основного титрування в ТХК - Теоретичні основи аналітичної хімії
Визначення соди. Якість препарату соди залежить від вмісту карбонату натрію. Крім того, сода вбирає вологу і залежно від способу виготовлення й...
-
Класифікація методів аналізу - Теоретичні основи аналітичної хімії
Хімічні й фізико хімічні методи аналізу. Загальна схема хімічних і фізико-хімічних методів аналізу зводиться до того, що досліджувану речовину переводять...
-
Комплексонометричний метод, його значення - Теоретичні основи аналітичної хімії
Реакції утворення комплексних і малодисоційованих сполук є основою визначення ряду іонів. Найбільше значення в титриметричному аналізі має...
-
Розглянемо емпіричну залежність y=a+bx (1). Так як це лінійна функція, то ні яких перетворень не буде і x та y лишаються без будь-яких перетворень...
-
Метод найменших квадратів - Визначення наявності лінійного зв'язку між в'язкістю та теплоємкістю
Емпірична формула в загальному виді може бути записана так: = F(хi, aj), Де хi - незалежні змінні, aj - коефіцієнти емпіричної залежності. Відповідно до...
-
Лінійний регресійний аналіз - Визначення наявності лінійного зв'язку між в'язкістю та теплоємкістю
Дослідження й оптимізація складних, неорганізованих систем можливі лише за допомогою Рівняння регресії . Проте не завжди експериментальний матеріал дає...
-
Введення, Кореляційний аналіз - Визначення наявності лінійного зв'язку між в'язкістю та теплоємкістю
Математичне опрацювання і аналіз результатів експерименту необхідні як студентам технічних вузів, так і інженерам-дослідникам і інженерам-технологам....
-
Перед пошуком розв'язку задачі зробимо деякі перетворення в моделі. Для перетворимо рівняння (2.2) і отримаємо: Отримаємо: Тепер підставимо отриманий...
-
В основі моделі (2.2.) - (2.6) лежить рівняння, яке має вигляд: , Зробимо просте перетворення, зробивши заміну: (2.7) І отримаємо рівняння (2.8): (2.8)...
-
Основні методи гравіметричного аналізу - Теоретичні основи аналітичної хімії
Від чіткого розділення досліджуваної речовини залежить весь аналіз. Осад повинен бути чистим і без домішок. Звичайно, в процесі роботи осад захоплює з...
-
BONAQUA МОРШИНСЬКА ЗНАМЕНІВСЬКА МИРГОРОДСЬКА Статистична обробка результатів аналізу Перевірка отриманих результатів вимірювання загальної лужності...
-
1). Изменения жира молока при тепловой обработке. 2). Изменение лактозы при тепловой работке. 3). Влияние нагревания на солевой состав, витаминный и...
-
Засоби вимірювання - мірні колби на 50, 100, 250 см3; - терези аналітичні та важки до них; - циліндри на 10, 25 см3; - індикатори: метилоранж; - хлоридна...
-
У роботі розглядаються безперервні функції F З періодом 2p і їх наближення тригонометричними поліномами. Через Tn(x) Позначається тригонометричний...
-
Использование предшественников при производстве аминокислот позволяет успешно обходить метаболический контроль, осуществляющийся по механизму обратной...
-
Визначення : Скалярний добуток двох векторів і дорівнює добутку модулів цих векторів на косинус кута між ними . (6.1) Таким чином, скалярний добуток двох...
-
Перевірка отриманих результатів вимірювання на наявність грубих похибок за Q - критерієм при ? = 0,95 Де: Хі - отримані результати аналізу Перевірка...
-
Для аналізу відбираємо проби різних мінеральних вод в об'ємі 100 см3 за допомогою мірної колби. Переносимо в конічну колбу на 250 см3, додаємо 5 см3...
-
Засоби вимірювання - мірні колби на 50, 100, 250 см3; - терези аналітичні та важки до них; - терези технохімічні та важки до них; - циліндри на 10, 25...
-
Мірний посуд, його призначення - Теоретичні основи аналітичної хімії
Для точного вимірювання об'ємів розчинів в титриметричному аналізі використовують мірні колби, піпетки, бюретки. Кожний з цих видів посуду має цілком...
-
Комплексонометричне визначення кальцію та магнію грунтується на таких же реакціях, як і визначення твердості води. У сильнолужному середовищі при рН = 12...
-
Визначення кальцію титрометричними методами - Питні мінеральні води
Титрування кальцій оксалату розчином калій перманганату Кальцій оксалат осаджують і відфільтровують через скляний фільтруючий тигель №4. Потім тигель...
-
Висновок - Визначення наявності лінійного зв'язку між в'язкістю та теплоємкістю
При виконанні першої частини курсової роботи з заданих експериментальних даних, був проведений кореляційний аналіз і встановлена наявність лінійного...
-
Даний метод не є єдиним способом побудови інтерполяційного поліному. Інший підхід, яким часто користуються на практиці, називається методом Лагранжа....
Денатурація ферменту, Визначення амілолітичної (декстринуючої) активності - Вплив температури на активність амілаз