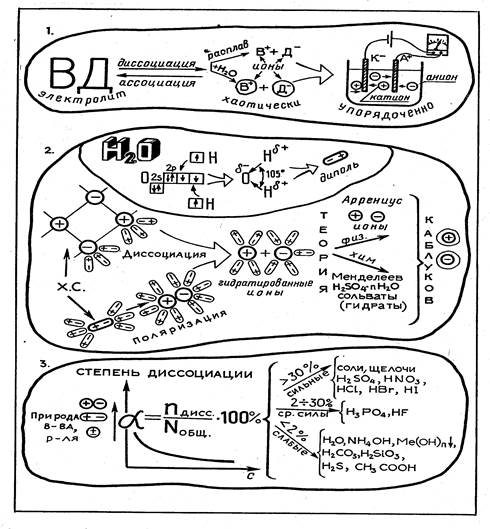
Степень диссоциации. Сильные и слабые электролиты - Обобщающие схем-конспекты по теме "Электролитическая диссоциация"
Количественно процесс диссоциации вещества в растворе можно оценить по степени диссоциации а. Ее рассчитывают как отношение числа молекул электролита, распавшихся на ионы, к общему числу молекул растворенного вещества и выражают в процентах.
Степень диссоциации а зависит от природы химической связи в кристаллах или молекулах растворенного вещества и растворителя. Чем полярнее эта связь, тем выше значение а. При разбавлении растворов а увеличивается (см. график, где с--концентрация раствора).
В зависимости от величины степени диссоциации все электролиты классифицируют на сильные (а>30 %), средней силы (а от 2 до 30 %), слабые (а<2 %).
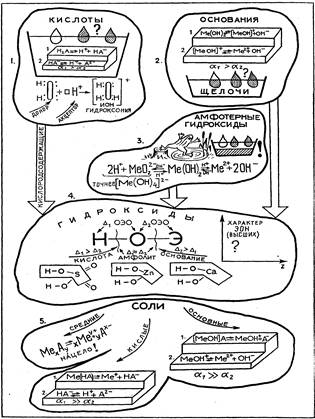
ОС-П. Кислоты, основания, амфотерные гидроксиды и соли как электролиты (см. с. 27)
1. Кислоты
Кислоты -- электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только катионы водорода (протоны). Наличием катионов водорода в растворах кислот и объясняются их общие свойства, в частности изменение окраски индикаторов.
Многоосновные кислоты диссоциируют ступенчато, причем по первой ступени степень диссоциации всегда больше, чем по последующим.
Процесс диссоциации кислот в водных растворах сопровождается донорно-акцепторным взаимодействием положительно поляризованных атомов водорода с молекулами воды, в результате чего образуются гидратированные ионы водорода (ионы гидроксония).
2. Основания
Основания--электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы ОН-. Двухкислотные основания диссоциируют ступенчато. При этом, как и в случае многоосновных кислот. Растворимые основания (щелочи) изменяют окраску индикаторов. Термины "амфотерность", "амфолит" отражают кислотно-основную двойственность вещества. Этот же корень содержится в слове "амфибия", о чем напоминает изображение лягушки. Амфотерные гидроксиды плохо растворимы в воде и не изменяют окраски индикаторов. Это слабые электролиты. Их двойственность проявляется в способности диссоциировать как по основному, так и по кислотному типу. В кислой среде усиливается диссоциация по основному типу, в щелочной -- по кислотному (с образованием гидроксокомплексных анионов, например [Al(OH)6]ff-, [Zn(OH)4]2-.4.
Сравнение графических формул кислородсодержащих кислот (например, H2SO4), амфотерных гидроксидов (Zn(OH)j) и оснований (Са(ОН)г) позволяет установить сходство в их строении: наличие одинаковой последовательности соединения атомов Н--О--Э. Это позволяет объединить указанные группы веществ общим понятием -- гидроксиды. Способность гидроксидов к диссоциации по кислотному, основному или амфотерному типу зависит от сравнительной полярности связей Н--О и О--Э. Если связь Н--О более полярна, чем О--Э, (разность между относительной электроотрицательностью кислорода и водорода (Дг ОЭО) больше разности ОЭО кислорода и элемента (Дг ОЭО), то гидроксид диссоциирует в водном растворе как кислота (отщепляя Нойоны). Если связь О,--Э более полярна, чем О--Н (Д2 ОЭО>Д ОЭО), то гидроксид диссоциирует по основному типу. И, наконец, если связи Н--О и О--Э примерно равнополярны (Д| ОЭО" "Дг ОЭО), гидроксид проявляет амфотерные свойства (амфолит).
5. Соли
В зависимости от состава соли подразделяют на средние, кислые и основные. Все соли -- сильные электролиты. Средние соли диссоциируют нацело на катионы металлов и анионы кислотных остатков. Кислые и основные соли диссоциируют ступенчато: по первой ступени -- как сильные электролиты (кислые соли -- на катионы металлов и гидроанионы, основные -- на гидроксо-катионы и анионы кислотных остатков); вторая ступень -- диссоциация гидроанионов (в случае кислых солей) или гидроксокатионов (в случае основных). Эти частицы обычно -- слабые электролиты (ai>a2).
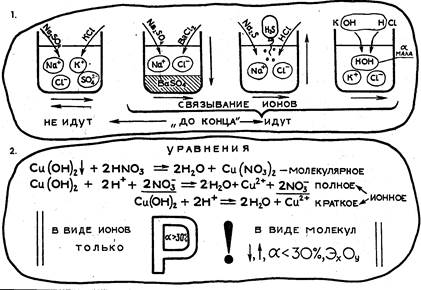
С-НГ. Реакции ионного обмена (см. с. 28)
1. Реакции ионного обмена
Реакции в растворах электролитов идут между ионами и направлены в сторону их большего "связывания" (образования нерастворимого вещества, газа или слабого электролита). Такие реакции практически необратимы, идут до конца. Ионные реакции, протекание которых не приводит к связыванию ионов, обратимы, не идут до конца.
2. Ионные уравнения
Реакции ионного обмена описываются как молекулярными, так и ионными уравнениями. Ионное уравнение составляют на основе молекулярного (с учетом коэффициентов). При этом согласно принятым правилам в ионном виде записывают формулы только сильных, хорошо растворимых электролитов. Формулы неэлектролитов (например, оксидов), а также слабых электролитов, малорастворимых и газообразных соединений записывают в молекулярном виде.
Краткое ионное уравнение получают после сокращения одинаковых членов в левой и правой частях полного ионного уравнения. Краткое ионное уравнение выражает суть реакции ионного обмена.
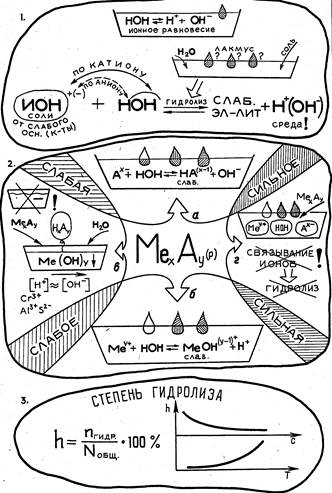
OC-IV. Гидролиз солей (см. с. 29)
1. Понятие о гидролизе
Вода -- слабый электролит. В чистой воде концентрации ионов водорода и гидроксид-ионов равны (спиртовой раствор индикатора окраску не изменяет). В растворах солей это равновесие может быть нарушено, если соль образована слабым основанием или слабой кислотой.
Взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и смещению ионного равновесия воды, называется гидролизом. Гидролиз солей -- частный случай ионных реакций.
Гидролизу подвергаются лишь те соли, в составе которых есть ион слабого основания (гидролиз по катиону) или слабой кислоты (гидролиз по аниону), так как только при этом условии происходит связывание ионов соли "противоионами" воды в слабый электролит; "несвязанные" ионы воды создают в растворах солей либо кислую, либо щелочную реакцию.
- 2. Влияние ионного состава солей на их взаимодействие с водой А) соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону. Это обратимый процесс. Краткое ионное уравнение (в общем виде) отражает взаимодействие одного аниона слабой кислоты с одной молекулой воды, приводящее к присоединению протона и образованию одной молекулы слабой одноосновной кислоты или одного гидроаниона слабой многоосновной кислоты. Реакция среды в растворе такой соли -- щелочная; Б) соли, образованные сильной кислотой и слабым основанием, гидролизуются по катиону. Это также обратимый процесс. Каждый ион слабого основания взаимодействует с одной молекулой воды, "отрывая" от нее один гидроксид-ион. При этом образуется либо слабое однокислотное основание, либо гидроксокатион слабого многокислотного основания. Реакция среды в растворах таких солей кислая; В) соли, образованные слабым основанием й слабой кислотой, подвергаются гидролизу в наибольшей степени (и по аниону, и по катиону), связывая и Н+, и ОН ионы воды. Реакция среды близка к нейтральной. В тех случаях; когда соль образована ионами слабого нерастворимого многокислотного основания и слабой летучей многоосновной кислоты (например, сульфиды А13+, Сг3+), гидролиз протекает мгновенно и необратимо. Такие соли не существуют в водном растворе, так как вступают с водой в необратимую химическую реакцию гидролиза, приводящую к образованию осадка слабого основания и летучей кислоты. В таблице растворимости такие соли отмечены прочерком; Г) соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, так как их ионы не могут связать ионы воды в слабый электролит. Реакция среды в растворах таких солей практически нейтральная. 3. Степень гидролиза
Количественно гидролиз характеризуется степенью гидролиза (ft). Это отношение числа гидролизованных "молекул" к общему числу молекул растворенной соли, выраженное в процентах. Помимо ионного состава, степень гидролиза соли зависит от температуры (Т) и концентрации (с) раствора. Чем меньше концентрация (т. е. чем более разбавлен раствор) и чем выше температура его, тем больше ft.
Анализ работы учителей позволяет дать некоторые рекомендации по практическому применению ОС в учебном процессе. При объяснении материала учителю целесообразно использовать крупные цветные ОС (плакаты, схемы на доске). В дальнейшем при необходимости можно подготовить кодотранспаранты и проецировать на экран блоки ОС.
Для самостоятельной работы учащихся на уроке и вне его удобны ксерокопии в виде индивидуального раздаточного материала. При этом черно-белые схемы станут более наглядными, если их раскрасить, выделив каждый блок цветом. В публикуемом варианте схемы "Гидролиз солей" вместо цвета использована штриховка: горизонтальная (вместо розового и красного цвета) для обозначения слабых и сильных кислотных свойств и вертикальная (вместо голубого и синего) для обозначения слабых и сильных основных свойств.
Для контроля знаний в кабинете химии полезно иметь и комплект так называемых слепых ОС (без формул, терминов, вместо которых стоят вопросительные знаки). Такие ОС подобно контурным картам можно предлагать учащимся для самостоятельного заполнения.
Похожие статьи
-
Вопрос об электролитической диссоциации веществ изучается в 8 классе в теме "Растворение. Растворы. Свойства растворов электролитов". Электролитическая...
-
Электролитическая диссоциация - Обобщающие схем-конспекты по теме "Электролитическая диссоциация"
Модульная программа "Электролитическая диссоциация" Интегрирующая цель. В результате работы над учебными элементами (УЭ-1 - УЭ-7): - закрепить знания по...
-
В молекуле воды связи О--Н полярны, электронная плотность этих связей смещена к атому кислорода как к более электроотрицательному. Вследствие этого на...
-
Комплект состоит из четырех обобщающих схем (ОС): OC-I. Электролитическая диссоциация. ОС-П. Кислоты, основания, амфотерные гидроксиды, соли как...
-
Как и минеральные кислоты, уксусная кислота взаимодействует с металлами, основными оксидами, основаниями и солями: Войства уксусной кислоты, характерные...
-
Тип урока. Изучение нового материала. Вид урока. Беседа с использованием учебного химического эксперимента. Цели. Обучающие: изучить сущность химических...
-
Методика изучения свойств оксидов в VII классе - Солеобразующие и несолеобразующие оксиды
При изучении свойств и классификации оксидов в VII классе мы применяем различные методические приемы, активизирующие познавательную деятельность...
-
Тема "Классы неорганических веществ" № п/п Число Тема урока 1 07.03. Кислотные оксиды 2 14.03. Общие свойства кислот: взаимодействие с индикаторами и...
-
Схемы и уравнения химических реакций - Схемы и уравнения химических реакций
При химических реакциях одни вещества превращаются в другие. Вспомним известную нам реакцию серы с кислородом. И в ней из одних веществ (исходных веществ...
-
Тестовые задания по теме "Моносахариды" - Модульное обучение в школе
Углеводы (сахара)*10 класс ЗАДАНИЕ. Среди предложенных утверждений выберите истинные. ВАРИАНТ 1 1. Глюкоза - важнейший представитель моносахаридов. 2....
-
Теоретическая поддержка темы "Глюкомза" (C6H12O6) - Модульное обучение в школе
("виноградный сахар", декстроза) встречается в соке многих фруктов и ягод, в том числе и винограда, отчего и произошло название этого вида сахара....
-
Карбоновые кислоты. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу Классификация. По числу карбоксильных групп карбоновые...
-
Методические разработки по теме: Основные классы - Солеобразующие и несолеобразующие оксиды
Неорганических соединений Цель. Обобщить и систематизировать знания по теме "Основные классы неорганических соединений", подготовиться к контрольной...
-
Оксиды - Солеобразующие и несолеобразующие оксиды
Существует несколько оксидов, которые в обычных условиях не реагируют ни с кислотами, ни со щелочами. Такие оксиды называют Несолеобразующими . Это,...
-
Для закрепления практических умений необходимо перед объяснением нового материала рассмотреть в учебнике рисунки 83--85 о растворении хлороводорода в...
-
Методические разработки по теме: "Моносахариды" - Модульное обучение в школе
Урок по теме: "Глюкоза -- представитель моносахаридов" Тема урока: "Глюкоза - представитель моносахаридов". Цели урока: 1. Расширение и углубление знаний...
-
Изучение темы "Спирты" имеет важное значение в формировании у учащихся основных понятий органической химии. На материале этой темы прежде всего...
-
Цели. Воспитательные . Воспитание коллективизма, экологической культуры, бытовой компетентности учащихся. Развивающие: Развитие умения делать выводы,...
-
Урок - ролевая игра Тип урока. Комбинированный: обобщение и систематизация знаний с элементами изучения нового материала. Цели урока. 1. Образовательные:...
-
В результате изучения темы учащиеся должны знать общие и специфические свойства галогенов, свойства и применение хлороводорода, соляной кислоты, уметь...
-
Цели и задачи урока: - Познакомить учащихся с нефтью как естественноисторическим телом, гипотезами происхождения нефти, составом и свойствами. - Углубить...
-
К изучению закономерностей химических реакций в VIII классе - Схемы и уравнения химических реакций
Изучение закономерностей химических реакций имеет важнейшее значение для формирования у учащихся системы понятий о химическом превращении веществ,...
-
Схема создания электронного учебника По сути, мультимединое сопровождение - это полноценный учебник (или его часть), только представленный на электронном...
-
Учебное познание в этой теме строится от внешнего знакомства с веществом и химической реакцией вглубь к молекулам, атомам, а в последующих темах уже к...
-
Карбоновые кислоты. Цели. Рассмотреть строение, свойства, получение и применение карбоновых кислот; развить навыки самостоятельной работы учащихся с...
-
При изучении общей характеристики галогенов нужно постоянно опираться на уже усвоенные учащимися представления о взаимосвязи между химическими элементами...
-
Как обеспечить безопасность ученических опытов - Техника безопасности на уроках химии
Ряд опытов, приведенных в школьных учебниках химии, нуждается и усовершенствовании, так как их выполнение связано с образованием высоких концентраций...
-
Сложные эфиры. - Организация самостоятельной работы при изучении карбоновых кислот
Среди функциональных производных кислот особое место занимают Сложные эфиры - производные кислот, у которых атом водорода в карбоксильной группе заменен...
-
Металлы - Солеобразующие и несолеобразующие оксиды
В кристаллах металлов и в их расплавах атомные остовы связывает единое электронное облако металлической связи. Как и отдельный атом элемента, образующего...
-
Теоретическое моделирование как основной метод познания в химии В теории познания одним из методов освоения окружающей действительности является...
-
При изучении темы "Галогены" учитель должен чаще предоставлять учащимся самостоятельность, обучая их применению теоретических знаний при анализе...
-
1. Что общего в строении атомов галогенов? 1) заряд ядра атома 2) радиус атома 3) одинаковое число электронов на наружном электронном слое 4) до октета...
-
Особенности изучения темы "Интеграл" в школьном курсе математики Выбор темы "Интеграл" неслучаен. Тема "Интеграл" изучается в рамках программы 11 класса...
-
Ответ. Уравнение - это равенство с переменой. Если соединить f(х) и g(х) два выражения с переменной х - и областью определению х, тогда высказывательная...
-
Тема1. Педагогика как наука. Различные подходы к пониманию педагогики. Педагогика как наука. Основные этапы развития педагогики. Объект и предмет...
-
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения его учения изложены в работе...
-
Объект исследования: процесс обучения на старшей ступени общего образования. Предмет исследования: система заданий интегративного характера как средство...
-
Атомно-молекулярное учение начинают рассматривать в школьном курсе химии в теме "Первоначальные химические понятия". Именно здесь формируются с...
-
Проверка и оценка знаний учащихся на уроке - завершающий этап обучения. Основная цель этой составной части урока - определение качества усвоения...
-
Современный этап развития школы характеризуется изменением образовательных ценностей: на смену предметно-ориентированному обучению приходит...
Степень диссоциации. Сильные и слабые электролиты - Обобщающие схем-конспекты по теме "Электролитическая диссоциация"