ТЕОРЕТИЧЕСКАЯ ПОДДЕРЖКА ТЕМЫ: ОРГАНИЧЕСКИЕ КИСЛОТЫ, Карбоновые кислоты. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу - Организация самостоятельной работы при изучении карбоновых кислот
Карбоновые кислоты. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
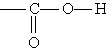
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа - СООН), дикарбоновые, или двухосновные (две группы - СООН), и т. д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая).
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункциональными. Среди них различают галогенкарбоновые (например, CH2Cl-СООН), нитрокислоты (например, NО2-С6Н4СООН), аминокислоты (см. "Азотсодержащие соединения"), оксикислоты (например, СН3-СН(ОН)-СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют Высшими (жирными) кислотами.
Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая. Карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная и др. (см. табл.).
Карбоновые кислоты
|
Формула |
Систематическое название |
Тривиальное название |
|
Монокарбоновые кислоты | ||
|
НСООН |
Метановая |
Муравьиная |
|
СН 3СООН |
Этановая |
Уксусная |
|
C2H5COOH |
Пропановая |
Пропионовая |
|
C6H5COOH |
Бензойная |
Ѕ |
|
СН3(СН2)16СООН |
Октадециловая |
Стеариновая |
|
CH2==CH-СООН |
Пропеновая |
Акриловая |
|
Дикарбоновые кислоты | ||
|
НООС-СООН |
Этандиовая |
Щавелевая |
|
НООС-CH2-СООН |
Пропандиовая |
Малоновая |
|
НООС-СН2-CH2-СООН | p>Бутандиовая |
Янтарная |
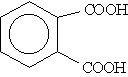
Бензол-1,2-дикарбоновая |
Фталевая | |
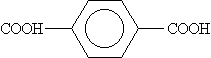
Бензол-1,4-дикарбоновая |
Терефталевая |
Названия ароматических кислот производят от бензойной кислоты, например:
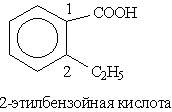
Изомерия. Возможны следующие виды изомерии:
- 1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров: масляной и изомасляной (2-метилпропановой) кислот. 2. Изомерия положения кратной связи, например:
СН2=СН-СН2-СООН СН3-СН=СН-СООН
Бутен-3-овая кислота Бутен-2-овая кислота (винилуксусная кислота) (кротоновая кислота)
3. Цис-, транс-изомерия, например:
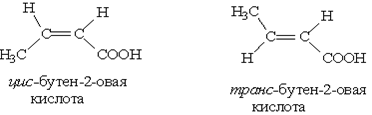
- 4. Межклассовая изомерия: например, масляной кислоте (СН3-СН2-CH2-СООН) изомерны метиловый эфир пропановой кислоты (СН3-СН2-СО-О-СНз) и этиловый эфир уксусной кислоты (СН3-СО-О - CH2-СН3). 5. У гетерофункционалъных кислот возможна изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и 4-хлорбутановая. Для гетерофункциональных кислот возможна также оптическая изомерия.
Способы получения. 1. Окисление альдегидов и первичных спиртов - общий способ получения карбоновых кислот:
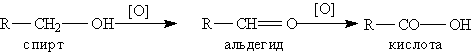
2. Другой общий способ - гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
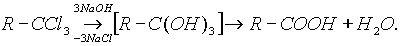
3. Взаимодействие реактива Гриньяра с СО2:
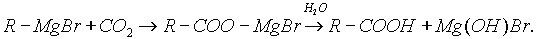
4. Гидролиз сложных эфиров:
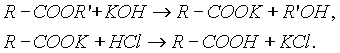
- 5. Гидролиз ангидридов кислот: 6. Для отдельных кислот существуют специфические способы получения:
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
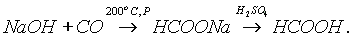
Уксусную кислоту получают в промышленных масштабах каталитическим окислением бутана кислородом воздуха:
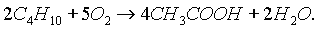
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия (см. "Ароматические углеводороды"):
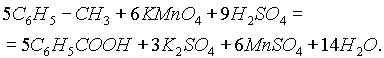
Физические свойства. Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой СNН2n+1СООН. Низшие члены этого ряда (С1- С9) представляют собой жидкости, обладающие характерным острым запахом. Средние представители ряда-вязкие, "маслообразные" жидкости; начиная с С10 - твердые вещества.
Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
Ненасыщенные кислоты, как правило, жидкости.
Все дикарбоновые и ароматические кислоты при комнатной температуре - кристаллические вещества.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С=O и гидроксильной группы ОН, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается и связь O-Н ослабляется (увеличиваются кислотные свойства):
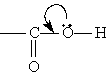
В свою очередь, группа ОН "гасит" положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Химические свойства. 1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
Однако это равновесие диссоциации сильно сдвинуто влево, поэтому Карбоновые кислоты, как правило, Слабые кислоты.
Вследствие взаимного влияния атомов в молекулах дикарбоновых кислот они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот: реагируют с активными металлами, основными оксидами, основаниями:
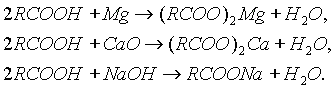
Карбоновые кислоты - слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
3. Образование функциональных производных. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R-СО-X; здесь R означает алкильную либо арильную группу.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
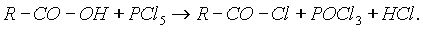
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
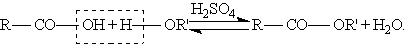
Механизм реакции этерификации был установлен методом "меченых атомов".
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию Амидов:
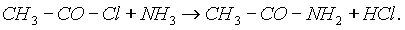
Амидами карбоновых кислот называются производные этих кислот, в которых гидроксилъная группа замещена на аминогруппу.
Например:
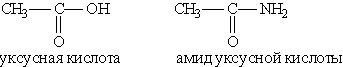
Общая формула амидов RCONH2. Функциональная группа СONH2 называется амидогруппой. Названия амидов производят от названий кислот, из которых они образовались, с добавлением слова Амид.
Физические свойства амидов. Амид муравьиной кислоты - жидкость, амиды всех других кислот - белые кристаллические вещества. Низшие амиды хорошо растворимы в воде. Водные растворы амидов дают нейтральную реакцию на лакмус.
Важнейшее свойство амидов - способность их к гидролизу в присутствии кислот и щелочей. При этом образуются кислота и аммиак:
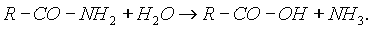
К амидам кислот относится мочевина. Это конечный продукт азотистого обмена в организме человека и животных. Образуется при распаде белков и выделяется вместе с мочой. Мочевину можно рассматривать как полный амид угольной кислоты:
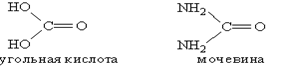
Мочевина, или карбамид, - белое кристаллическое вещество, хорошо растворимое в воде. Впервые была получена немецким ученым Велером в 1828 г. из цианата аммония:
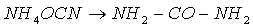
Это первое органическое соединение, полученное синтетическим путем. В промышленности мочевину получают из оксида углерода (IV) и аммиака при нагревании (150° С) и высоком давлении:
С сильными минеральными кислотами мочевина образует соли:
Мочевина - ценное высококонцентрированное азотное удобрение (46,6% азота), широко используется на всех почвах и под все культуры. Как источник азота, ее добавляют в корм скоту. Применяется также как исходное вещество для получения мочевиноформальдегидных смол и лекарственных веществ (люминала, веронала и др.).
4. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на свету образуются ? - галогензамещенные кислоты:
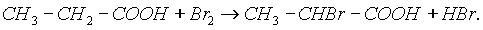
Непредельные карбоновые кислоты способны к реакциям присоединения.
5. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей способны превращаться в альдегиды или спирты:
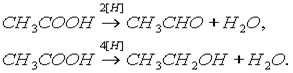
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
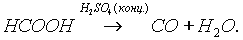
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
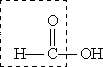
Муравьиная кислота - сильный восстановитель и легко окисляется до СО2. Она дает реакцию "серебряного зеркала":
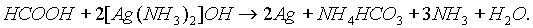
Кроме того, муравьиная кислота окисляется хлором:
Похожие статьи
-
Карбоновые кислоты. Цели. Рассмотреть строение, свойства, получение и применение карбоновых кислот; развить навыки самостоятельной работы учащихся с...
-
Сложные эфиры. - Организация самостоятельной работы при изучении карбоновых кислот
Среди функциональных производных кислот особое место занимают Сложные эфиры - производные кислот, у которых атом водорода в карбоксильной группе заменен...
-
В настоящее время перед современной школой ставится проблема повышения уровня самостоятельности учебного труда школьников в процессе обучения, вооружения...
-
Цели. Воспитательные . Воспитание коллективизма, экологической культуры, бытовой компетентности учащихся. Развивающие: Развитие умения делать выводы,...
-
Вот двух кислот портрет, Слушайте дальше ответ. Пришла пора итоги подвести, Как говорят, Поставить точки все над i. Фирма покупателей проводит небольшой...
-
Портрет уксусной кислоты - Организация самостоятельной работы при изучении карбоновых кислот
Под звуки музыки раскладывается календарь - листы с большими рисунками по следующему ниже тексту. Из всех кислот Она, конечно, прима, Присутствует везде...
-
Как и минеральные кислоты, уксусная кислота взаимодействует с металлами, основными оксидами, основаниями и солями: Войства уксусной кислоты, характерные...
-
- Из ацетилена по реакции Кучерова получают уксусный альдегид (ацетилен получают из доступного сырья - метана), окисление альдегида дает кислоту: -...
-
В соответствии с требованиями жизни следует создавать условия для приобретения учащимися опыта учебно-познавательной деятельности, воспитания их...
-
Изучение темы "Спирты" имеет важное значение в формировании у учащихся основных понятий органической химии. На материале этой темы прежде всего...
-
При изучении общей характеристики галогенов нужно постоянно опираться на уже усвоенные учащимися представления о взаимосвязи между химическими элементами...
-
Самостоятельная работа учащихся на уроках ведется по специальному заданию. От цели, содержания, формы задания зависит характер деятельности школьников....
-
Учебник как основное средство обучения В России естествознание как учебный предмет было введено в 1786 году. В то же время был написан первый учебник...
-
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения его учения изложены в работе...
-
Для закрепления практических умений необходимо перед объяснением нового материала рассмотреть в учебнике рисунки 83--85 о растворении хлороводорода в...
-
Урок - ролевая игра Тип урока. Комбинированный: обобщение и систематизация знаний с элементами изучения нового материала. Цели урока. 1. Образовательные:...
-
Приведенная выше контрольная работа была проведена в 8 "А" классе, где изучение темы проходило по экспериментальной программе, и в 8 "Б" классе, где та...
-
Тема "Классы неорганических веществ" № п/п Число Тема урока 1 07.03. Кислотные оксиды 2 14.03. Общие свойства кислот: взаимодействие с индикаторами и...
-
Подведение итогов, ЛИТЕРАТУРА - Организация самостоятельной работы при изучении карбоновых кислот
Во время урока участникам раздаются жетоны разного цвета. Красный жетон - очень хороший ответ. Желтый и синий жетоны - хороший ответ. Зеленый жетон -...
-
При постановке целей и задач самостоятельной работы необходимо учитывать следующие дидактические требования: 1. Самостоятельная работа должна носить...
-
В дидактической и методической литературе можно встретить различные классификации типов и видов самостоятельной работы учащихся по различным основаниям и...
-
При создании учебника "Окружающий мир" авторский коллектив А. А. Плешакова учитывал возрастные особенности детей 8-9 лет. К этому возрасту у детей...
-
1) Изучение новой темы (методика Ривина) и взаимопередача темы 10 класс, "Углеводы. Сахароза" Часть 1. Физические свойства и нахождение в природе....
-
В результате изучения темы учащиеся должны знать общие и специфические свойства галогенов, свойства и применение хлороводорода, соляной кислоты, уметь...
-
Теоретическое моделирование как основной метод познания в химии В теории познания одним из методов освоения окружающей действительности является...
-
Тип урока. Изучение нового материала. Вид урока. Беседа с использованием учебного химического эксперимента. Цели. Обучающие: изучить сущность химических...
-
В настоящее время каждый учитель математики ставит перед собой задачу не только сообщить школьникам определенную сумму знаний, наполнить их память...
-
Возможности учебника "Окружающий мир" для формирования самостоятельности В исследованиях ряда авторов отмечается, что решающим фактором в воспитании...
-
Каждый учебник должен нести в себе определенные функции. Исследованием данной проблемы занимался Д. Д.Зуев. Он выделил и всесторонне описал функции...
-
Каждый учебник "Окружающего мира" имеет определенную структуру, которая представлена структурными компонентами. В учебниках выделяют два основных блока...
-
Оценка достижений учащихся в начальной школе Совершенствование системы начального образования направлено на решение ряда важнейших задач, среди которых...
-
Особенности изучения темы "Интеграл" в школьном курсе математики Выбор темы "Интеграл" неслучаен. Тема "Интеграл" изучается в рамках программы 11 класса...
-
Знакомство с образцами, веществ и их свойствами, как всегда, осуществляется в процессе демонстрации соответствующих опытов при строгом соблюдении техники...
-
Атомно-молекулярное учение начинают рассматривать в школьном курсе химии в теме "Первоначальные химические понятия". Именно здесь формируются с...
-
1. Что общего в строении атомов галогенов? 1) заряд ядра атома 2) радиус атома 3) одинаковое число электронов на наружном электронном слое 4) до октета...
-
Теоретическая поддержка темы "Глюкомза" (C6H12O6) - Модульное обучение в школе
("виноградный сахар", декстроза) встречается в соке многих фруктов и ягод, в том числе и винограда, отчего и произошло название этого вида сахара....
-
На уроках химии при изучении вопросов, связанных с производственной тематикой, уделяется большое внимание не только рассмотрению химических процессов,...
-
При изучении темы "Галогены" учитель должен чаще предоставлять учащимся самостоятельность, обучая их применению теоретических знаний при анализе...
-
Решение задач способствует осуществлению связи теории с практикой, глубокому пониманию и закреплению изучаемого материала, а также привитию учащимся...
-
Методические разработки по теме: "Моносахариды" - Модульное обучение в школе
Урок по теме: "Глюкоза -- представитель моносахаридов" Тема урока: "Глюкоза - представитель моносахаридов". Цели урока: 1. Расширение и углубление знаний...
ТЕОРЕТИЧЕСКАЯ ПОДДЕРЖКА ТЕМЫ: ОРГАНИЧЕСКИЕ КИСЛОТЫ, Карбоновые кислоты. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу - Организация самостоятельной работы при изучении карбоновых кислот