Методические разработки по теме: Основные классы - Солеобразующие и несолеобразующие оксиды
Неорганических соединений
Цель. Обобщить и систематизировать знания по теме "Основные классы неорганических соединений", подготовиться к контрольной работе.
Задачи. Обучающие. Повторить основные понятия темы: оксиды, кислоты, основания, соли, реакция нейтрализации, типы химических реакций, индикаторы; проверить умения составлять уравнения химических реакций, экспериментально распознавать кислоты, щелочи и соли, решать цепочки химических превращений; анализировать и систематизировать вещества по их строению, составлять вопросы при просмотре видеосюжета и отвечать на вопросы, делать выводы и обобщать.
Развивающие. Развивать мышление (анализ, соотнесение, тезаурус* данной темы), долговременную память, интерес к предмету.
Воспитательные. Воспитывать культуру химического эксперимента: соблюдение правил техники безопасности при работе, поведение в кабинете химии, наблюдательность при просмотре видеосюжета, умение находить и решать экологические проблемы.
Урок рассчитан на 40 мин.
ХОД УРОКА
Организационный момент
Учащиеся заранее распределяются по командам (если в классе всего 14 человек, то получается 2 команды по 7 человек), выбирают капитана каждой команды. Команда № 1 - "Атом", команда № 2 - "Молекула".
Учитель объясняет правила игры.
Правила игры
- 1. После каждого этапа учитель подводит итоги конкурса и выставляет баллы каждой команде. 2. Капитан команды назначает своих участников ответственными по каждому конкурсу. 3. Если кто-либо в команде в течение всей игры не принимает в ней участия, то со всей команды снимаются баллы.
Конкурс 1 "Найди родственников"
Командам выдаются карточки с формулами веществ.
За 1 мин команде "Атом" необходимо выбрать из предложенного перечня веществ все оксиды и кислоты, а команде "Молекула" - все основания и соли и записать их в таблицу.
Максимальная оценка за конкурс - 2 балла (1 балл за правильное распределение и название веществ, еще 1 - за участие всей команды).
Карточка Команды "Атом" - Na2SO3, H2SO4, CrO3, HNO3, MgO, NaNO3, KOH.
Карточка Команды "Молекула" - Mg(OH)2, H2SO4, ZnCl2, HNO3, MgO, NaNO3, KOH.
Конкурс 2 "Третий лишний"
За 1 мин необходимо найти на каждой строке лишнюю формулу вещества и объяснить, почему именно эта формула лишняя.
Задание команде "Атом". Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ:
- 1) H2О, K2SO4, SO2 - ... ; 2) BaSO4, HCl, CuCl2 - ... ; 3) NaOH, CuO, Cu(OH)2 - ... ; 4) H2SO3, HCl, KNO3 - ... .
Задание команде "Молекула". Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ:
- 1) H2SO3, LiNO3, H2SO4 - ... ; 2) NaOH, Ba(OH)2, H2S - ... ; 3) Na2CO3, P2O5, MgO - ... ; 4) AlPO4, CuSO4, Zn(OH)2 - ... .
Конкурс 3 "Экспертиза"
Каждой команде выдается по три пробирки с веществами: NaOH, HCl, NaCl (можно выдать приборы для работы в парах). За 1 мин, используя растворы индикаторов метилоранжа и фенолфталеина, необходимо распознать, в какой пробирке находится каждое вещество, и объяснить почему. Максимальная оценка за конкурс - 2 балла. Учитель после ответа команд сам определяет, про какой из выданных индикаторов более подробно расскажет каждая команда.
После выполнения эксперимента представители команд читают стихи про фенолфталеин и метилоранж.
Фенолфталеин
Попасть в кислоту - есть ли горше удача?
Но он перетерпит без вздохов, без плача.
Зато в щелочах у фенолфталеина
Начнется не жизнь, а сплошная малина.
Метилоранж
От щелочи я желт, как в лихорадке,
Краснею от кислот, как от стыда.
Но бросаюсь в воду без оглядки,
И здесь уж не заест меня среда.
Конкурс 4 "Восстанови запись"
Командам выдаются бланки с заданием. За 4 мин необходимо дописать пропущенные вещества, расставить коэффициенты и указать тип реакции. Затем команды обмениваются выполненными заданиями и проверяют их в течение 2 мин. Каждое правильно записанное уравнение реакции оценивается в 1 балл.
Задание команде "Атом"
- 1) ... + ... = CuCl2 + 2H2O; 2) Mg + Cl2 = ... ; 3) Fe(OH)3 = ...+ ... ; 4) ... + ... = CaCl2; 5) CuO + ... = CuSO4 + ... ; 6) ... + 6HCl = 2FeCl3 + 3... .
Задание команде "Молекула"
- 1) ... + ... = NaCl + H2O; 2) K + Cl2 = ... ; 3) Cu(OH)2 = ... + ... ; 4) ... + ... = MgO; 5) CaO + 2... = Ca(NO3)2 + ... ; 6) ... + 2HCl = ZnCl2 +... .
Конкурс 5 "Блиц"
Каждой команде выдаются карточки с цифрами 1, 2, 3. Ответы на вопросы ученики дают, поднимая карточки с нужной цифрой. Вопросы задает учитель.
- 1. Какую кислоту называют "купоросным маслом": 1) серную; 2) соляную; 3) азотную? 2. Какая кислота содержится в желудочном соке человека: 1) серная; 2) соляная; 3) азотная? 3. Какое из перечисленных взаимодействий нехарактерно для кислотных оксидов: 1) с кислотами; 2) с основаниями; 3) с основными оксидами? 4. Какое из перечисленных утверждений нехарактерно для щелочей: 1) растворимы в воде; 2) взаимодействуют с кислотами; 3) взаимодействуют с основаниями?
Конкурс 6 "Посмотри и ответь"
Учащимся демонстрируется видеосюжет по теме "Кислотные дожди" без звукового сопровождения. Во время просмотра необходимо составить вопросы к видеосюжету. После просмотра команды по очереди задают друг другу вопросы и отвечают на них. За каждый вопрос и правильный ответ ставится 1 балл.
Конкурс 7 "Зашифрованная цепь"
Задание команде "Атом"
Напишите уравнения реакций для цепочки химических превращений.
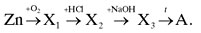
Задание команде "Молекула"
Напишите уравнения реакций для цепочки химических превращений.
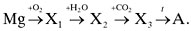
За 4 мин командам необходимо написать уравнения реакций, расставить коэффициенты и указать типы реакций. Затем они обмениваются выполненными заданиями и проверяют друг друга. Время на проверку - 2 мин.
Конкурс 8 "Знание тезауруса"
Каждому члену команды выдается тест на проверку тезауруса с учетом уровня подготовки (табл. 1-3). Время на выполнение любого уровня (А, В, С) - 3 мин.
Задание. Во втором столбце табл. 1 (См. с. 41) записаны химические понятия, в третьем - толкования этих понятий. Среди них есть истинные толкования и ложные. В четвертом столбце напротив каждого толкования надо написать одну букву: И - если это истинное толкование, Л - если это ложное толкование. Колонка "+/-" - для подсчета верных ответов.
Если вы набрали 14-13 "+", то оценка "5",
- 12-11 "+" - оценка "4", 10-9 "+" - оценка "3".
Если у вас от 8 и меньше "+", то повторите тему и выполните тест еще раз.
Задание. Во втором столбце табл. 2 (См. с. 42) записаны химические понятия, в третьем - толкования этих понятий. Среди них есть истинные толкования и ложные. В четвертом столбце напротив каждого толкования надо написать одну букву: И - если это истинное толкование, Л - если это ложное толкование. Колонка "+/-" для подсчета верных ответов.
Если вы набрали 18-17 "+", то оценка "5",
- 16-15 "+" - оценка "4", 14-13 "+" - оценка "3".
Если у вас от 12 и меньше "+", то повторите тему и выполните тест еще раз.
Задание. Во втором столбце табл. 3 (См. с. 43, 44) записаны химические понятия, в третьем - толкования этих понятий. Среди них есть истинные толкования, неполные истинные и ложные. В четвертом столбце напротив каждого толкования надо написать одну букву: И - если это истинное толкование, Н - если это неполное истинное толкование, Л - если это ложное толкование. Колонка "+/-" для подсчета верных ответов.
Учащиеся разбиваются по парам, им выдаются ключи, по которым они проверяют друг друга и выставляют оценки.
Итоги конкурсов
Учитель в роли главного судьи подводит итоги конкурсов. Он подсчитывает сумму баллов каждой команды и выставляет оценки каждому члену команды. (За всякого не принимавшего участия в игре учащегося из копилки команды вычитается по 1 баллу.)
Домашнее задание
1. С каким из перечисленных веществ будет взаимодействовать раствор HCl: Zn, Cu, H2O?
Напишите уравнение возможной реакции, укажите ее тип и расставьте коэффициенты. Назовите образующуюся соль.
2. Напишите уравнения реакций, для цепочки превращений:
Ca CaO Ca(OH)2.
- 1-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор NaOH: CO2, Cu(OН)2, HCl, CuCl2? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций для цепочки превращений:
Ca CaO Ca(OH)2 CaCl2.
- 3. Определите массу гидроксида натрия, образующегося при взаимодействии 31 г оксида натрия с водой. 2-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор HCl: Zn, Cu, SO2, Ca(OН)2, HNO3, MgO? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций для цепочки превращений:
Zn ZnO ZnCl2 Zn(OH)2.
- 3. Определите массу хлорида цинка, который образуется при взаимодействии 65 г цинка с соляной кислотой. 3-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор СuCl2: SO2, NaOН, H2SO3, AgNO3, Ca? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций для цепочки превращений:
Р Р2O5 H3РО4 Ba3(РO4)2.
- 3. Определите массу хлорида кальция, который образуется при взаимодействии 100 г кальция с хлоридом меди(II). 4-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор Са(OH)2: SO2, NaOН, H2SO4, ZnCl2? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций для цепочки превращений:
Li Li2O LiOH LiCl.
- 3. Определите массу гидроксида лития, образующегося при взаимодействии 46 г оксида лития с водой. 5-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор H2SO4: SO2, Cu(OН)2, HCl, Al, Cu, CuO? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций цепочки превращений:
Zn ZnO ZnCl2 > Zn(OH)2.
- 3. Определите массу сульфата цинка, который образуется при взаимодействии 130 г цинка с серной кислотой. 6-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор СuSO4: SO2, NaOН, HCl, BaCl2, Mg? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций для цепочки превращений:
- S SO2 H2SO3 CaSO3.
Оксид цинка хлорид цинка гидроксид цинка.
- 3. Определите массу гидроксида калия, образующегося при взаимодействии 95 г оксида калия с водой. 2-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор серной кислоты: оксид серы(IV), гидроксид натрия, серная кислота, хлорид бария, оксид кальция? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций для цепочки превращений:
Оксид серы(IV) оксид серы(VI) серная кислота сульфат бария.
- 3. Определите массу оксида меди(II), который образуется при разложении 306 г гидроксида меди(II). 3-й Вариант 1. С какими из перечисленных веществ будет взаимодействовать раствор силиката натрия: оксид углерода(IV), гидроксид калия, азотная кислота, хлорид меди(II), калий? Напишите уравнения протекающих реакций, укажите тип каждой реакции и расставьте коэффициенты. Назовите образующиеся соли. 2. Напишите уравнения реакций для цепочки превращений:
Оксид ртути(II) хлорид ртути(II) гидроксид ртути(II) оксид ртути(II).
3. При взаимодействии 40 г кальция с раствором 1 моль сульфата цинка образовались соль и металл. Определите массу образовавшейся соли.
Похожие статьи
-
Тип урока. Изучение нового материала. Вид урока. Беседа с использованием учебного химического эксперимента. Цели. Обучающие: изучить сущность химических...
-
Методика изучения свойств оксидов в VII классе - Солеобразующие и несолеобразующие оксиды
При изучении свойств и классификации оксидов в VII классе мы применяем различные методические приемы, активизирующие познавательную деятельность...
-
Урок №1. Внешнее строение и образ жизни насекомых Цель урока: Познакомить с представителями нового для учащихся класса животных. Задачи урока:...
-
Что-то мы очень засиделись на местах, надо бы немного подвигаться. И сейчас как раз для этого будет проводиться эстафета. Каждая команда получает по...
-
Карбоновые кислоты. Цели. Рассмотреть строение, свойства, получение и применение карбоновых кислот; развить навыки самостоятельной работы учащихся с...
-
Задачи Урока: - сформировать у учащихся понятие о многообразии одноклеточных, особенностях строения и жизнедеятельности представителей типов Споровики,...
-
Урок №1. "Размножение и развитие птиц" Цель учителя: - обеспечить усвоение знаний об особенностях размножения и индивидуального развития птиц; -...
-
Урок №1. "Семя" Пословицы и поговорки: 1. Земля кормит людей как мать детей. 2. Забота и на песке колос вырастит. 3. У кого весной простой, у того амбар...
-
Урок №1. "Строение и функции мочевыделительной системы. Профилактика заболеваний" Методы: - рассказ; - беседа; - постановка проблемы; - самостоятельная...
-
Методические разработки по теме: "Моносахариды" - Модульное обучение в школе
Урок по теме: "Глюкоза -- представитель моносахаридов" Тема урока: "Глюкоза - представитель моносахаридов". Цели урока: 1. Расширение и углубление знаний...
-
Оксиды - Солеобразующие и несолеобразующие оксиды
Существует несколько оксидов, которые в обычных условиях не реагируют ни с кислотами, ни со щелочами. Такие оксиды называют Несолеобразующими . Это,...
-
Урок №1. Урок-лекция Вегетативное размноженипе Иероглифические письмена, относящиеся к эпохе Древнего царства, т. е. ко времени, лежащему за пределами 3...
-
Цели. Воспитательные . Воспитание коллективизма, экологической культуры, бытовой компетентности учащихся. Развивающие: Развитие умения делать выводы,...
-
Цели и задачи урока: - Познакомить учащихся с нефтью как естественноисторическим телом, гипотезами происхождения нефти, составом и свойствами. - Углубить...
-
Вопрос об электролитической диссоциации веществ изучается в 8 классе в теме "Растворение. Растворы. Свойства растворов электролитов". Электролитическая...
-
Электролитическая диссоциация - Обобщающие схем-конспекты по теме "Электролитическая диссоциация"
Модульная программа "Электролитическая диссоциация" Интегрирующая цель. В результате работы над учебными элементами (УЭ-1 - УЭ-7): - закрепить знания по...
-
Урок - ролевая игра Тип урока. Комбинированный: обобщение и систематизация знаний с элементами изучения нового материала. Цели урока. 1. Образовательные:...
-
Тестовые задания 1. Структурная единица почки: А) долька; Б) нефрон; В) лоханка; Г) малая чаша. 2. Образование вторичной мочи происходит: А) в мочевом...
-
Каждый из нас весной и в начале лета наверняка не раз видел довольно крупных (длиной 2-- 2,5 см) светло-коричневых жуков цилиндрической формы с...
-
Неметаллы - Солеобразующие и несолеобразующие оксиды
В отличие от металлов, неметаллы очень сильно отличаются друг от друга по своим свойствам - как физическим, так и химическим, и даже по типу строения....
-
Металлы - Солеобразующие и несолеобразующие оксиды
В кристаллах металлов и в их расплавах атомные остовы связывает единое электронное облако металлической связи. Как и отдельный атом элемента, образующего...
-
Урок №1. Отряд чешуекрылые Цели: Образовательная: - обеспечить в ходе урока знание учащимися отличительных признаков отряда чешуекрылые, показать...
-
Урок №1. Многообразие современных пресмыкающихся. Отряд Чешуйчатые Оборудование: скелеты ящерицы, ужа, влажные препараты гадюки, ужа, таблица "Тип...
-
Урок по теме "Спирты, их строение, свойства, получение, применение" Цели и задачи урока: 1. Добиться усвоения учащимися данной темы; 2. Сформировать...
-
1. Поставьте микроскоп штативом к себе на расстоянии 5--10 см от края стола. В отверстие предметного столика направьте зеркалом свет. Поместите...
-
Урок-лекция. Подкласс лилиид (лилиевидных) Он назван так по центральному порядку лилейных и одноименному семейству. Лилейные -- обычно луковичные травы,...
-
Процесс образования мочи почками регулируется нервной и гуморальной системами. Человек может контролировать процесс мочеиспускания, можно выработать...
-
1. Борисова Н. В., Ефимова Н. Н. Интеллектуальный тренинг на уроках биологии в 6-8 классах. Чебоксары, 2000 г. 2. Прокофьев О. Н. Удивительное рядом....
-
Это растение было в числе первых, возделываемых человеком. Его плод упоминается в древних легендах. У греков и римлян он был посвящен богине красоты, а...
-
На голове жука расположены ротовые органы и органы чувств. Впереди находится верхняя губа в виде поперечной пластинки. За ней видны две пары челюстей...
-
В результате изучения темы учащиеся должны знать общие и специфические свойства галогенов, свойства и применение хлороводорода, соляной кислоты, уметь...
-
Конкурс "Играй, ботаник!" - Методические особенности при изучении темы "Соцветия" на уроках биологии
1-й раунд Задание для 1-й команды: "Попробуй вспомнить" Прежде чем назвать свое соцветие, вы должны повторить все названные раньше. Например: Кисть...
-
1) Количество энергии, передаваемой с одного трофического уровня на другой, составляет от количества энергии предыдущего уровня: А) 1 %; Б) 5 %; В) 10 %;...
-
Ребята, сегодня у нас особый урок-игра, посвященный соцветиям. Чем же они привлекли наше внимание? Соцветия как соцветия: белые, желтые, красные,...
-
Количественно процесс диссоциации вещества в растворе можно оценить по степени диссоциации а. Ее рассчитывают как отношение числа молекул электролита,...
-
Интерактивное обучение представляет собой такую организацию учебного процесса, при которой практически все учащиеся оказываются вовлеченными в процесс...
-
1. К семейству Кошачьи относят : А) лисицу; Б) гиену; В) пантеру; Г) песца. 2. Особенность строения клыков хищных : А) мощные длинные клыки; Б) клыки...
-
Урок - лекция. Отряд Жуки Коровка глазчатая Жуки. Их насчитывается около 300 000 видов - это один из самых многочисленных отрядов класса насекомых. Мы...
-
Тематическое планирование уроков технологии в 11 классах Таблица 1. Сводный тематический план № урока Название темы Количество часов Дата 1 2 3 4 Рулевой...
-
Тема "Классы неорганических веществ" № п/п Число Тема урока 1 07.03. Кислотные оксиды 2 14.03. Общие свойства кислот: взаимодействие с индикаторами и...
Методические разработки по теме: Основные классы - Солеобразующие и несолеобразующие оксиды