Квалификация - Валидация фармацевтического производства
Для каждого критического объекта инфраструктуры должна быть проведена квалификация, которая, как правило, осуществляется в четыре последовательных этапа:
- - Квалификация проекта (DQ, DEsign QUalification) - Квалификация монтажа (IQ, INstallation QUalification) - Квалификация функционирования (OQ, OPerational QUalification) - Квалификация в эксплуатации (PQ, PErformance Qualification)
Квалификация проекта (DQ) направлена на документированное подтверждение пригодности проекта (конструкции, проектного решения) технических средств, инженерных систем и оборудования для их предполагаемого использования. Объем работ на этом этапе:
- - Описание системы (функция, параметры оборудования, особые характеристики) - Техническая документация (нормативные требования, документация по оборудованию) - Оценка конструкции (конструкционные материалы, оценка риска загрязнений) - Компоненты/элементы оборудования / системы - Анализ возможных отказов / дефектов - Анализ способа изготовления (критические параметры работ при изготовлении оборудования, требования по калибровке)
Квалификация монтажа (IQ) направлена на документированное подтверждение того, что технические средства, инженерные системы и оборудование сконструированы, оснащены и смонтированы в соответствии с рабочей документацией проекта и рекомендациями производителя. Объем работ на этом этапе:
- - Наличие достаточной документации - Наличие всех элементов в поставке - Правильность монтажа и подключений - Соответствие контактирующих материалов - Соответствие средств измерений
Квалификация функционирования (OQ) направлена на документированное подтверждение того, что технические средства, инженерные системы и оборудование функционируют должным образом по всему заявленному диапазону рабочих характеристик. Объем работ на этом этапе:
- - Приемлемость документации (инструкции по эксплуатации, обслуживанию); - Испытания, включающие условие или ряд условий, охватывающих верхний и нижний пределы рабочих параметров: - Срабатывание блокировок / сигнализаций.
Как правило, после этого этапа квалификации объект вводится в эксплуатацию.
Квалификация функционирования (PQ) проводится для инженерных систем, которые работают непрерывно, а также для оборудования со сложным управлением. Квалификация в эксплуатации - это документированное подтверждение того, что технические средства, инженерные системы и оборудование при совместном (или длительном) использовании могут надежно функционировать с получением воспроизводимых свойств продукта.
При этом, если производственная система оснащена автоматизированной системой мониторинга параметров, или обработки данных, дополнительно должна проводиться валидация компьютеризированной системы.
Валидация аналитических методик
Каждая аналитическая и микробиологическая методика, которая используется для контроля качества сырья, полупродукта или готового продукта должна пройти валидацию. Это означает, что мы обязаны получить доказательства пригодности такой методики для контроля конкретного продукта и соответственно, гарантии получения достоверных результатов. В этом плане, требования GMP полностью совпадают с требованиями ИСО 17025.
Валидация очистки
Процедуры очистки оборудования должны также пройти валидацию до того, как мы приступим к производству препарата на этом оборудовании. Прежде всего, эта валидация направлена на получение гарантий возможности проведения качественной очистки после изготовления такого продукта. По сути, это минимизация риска перекрестного загрязнения при переходе на производство другого продукта на этом же оборудовании. Если на оборудовании останутся остатки предыдущего продукта, это не будет обнаружено - так как отсутствует аналитический контроль именно на наличие таких примесей.
Валидация асептических условий
При производстве стерильных лекарственных средств с использованием асептических технологий до начала самого технологического процесса необходимо подтвердить, что на всем протяжении процесса изготовления препарата (т. е. длительность процесса), в продукт не попадает ни один микроорганизм. Валидация асептических условий проводится по сценарию имитации с помощью питательных сред.
Валидация технологического процесса
И непосредственно, валидация каждого из этапов технологического процесса проводится на 3-х последовательных сериях с учетом "наихудшего случая". И, что очень важно, валидация технологического процесса проводится отдельно для каждого продукта и его заявляемого размера серии. (рис. 1). Наихудший случай - это проведение процесса при таких условиях и обстоятельствах (для параметров процесса, режимов работы оборудования), которые имеют максимальные шансы вызвать отклонение процесса или несоответствие продукта по сравнению с идеальными условиями. Логика очень проста - если при таких условиях мы получаем качественный продукт, значит, гарантированно мы будем достигать качества внутри заданных диапазонов.
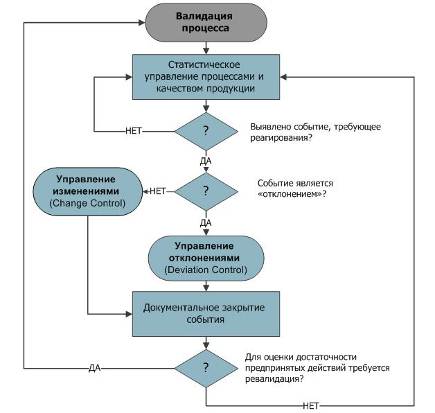
Схема надзора над валидированным процессом
Повторная валидация / квалификация
Через заданные периоды эксплуатации (использования), каждый объект / процесс должны пройти повторную валидацию. Основная цель повторной валидации (ревалидации) - это получить подтверждения того, что объект / процесс продолжает находиться в валидном состоянии. Это полностью отражает логику GMP: "Для подтверждения качества продукта недостаточно провести валидацию в начале его жизненного цикла, необходимо обеспечить мониторинг и постоянное улучшение".
Ретроспективная валидация может проводиться только для хорошо отработанных процессов. Проведение ее не допускается, если в состав продукции, технологический процесс или оборудование недавно были внесены изменения.
Источники данных для такой валидации должны включать (но не ограничиваться ими): протоколы производства и упаковки серий продукции, контрольные карты производства, журналы проведения технического обслуживания, данные об изменениях в персонале, исследования возможностей процесса, данные о готовой продукции, в том числе карты тенденций, а также результаты изучения ее стабильности при хранении.
Перспективная валидация должна включать следующие элементы (но не ограничиваться ими):
- - краткое описание процесса; - перечень критических стадий процесса, подлежащих исследованию; - перечень используемых помещений / оборудования (включая измерительное / контроль- - ное/регистрирующее оборудование) с указанием сведений об их калибровке; - спецификации на готовую продукцию при выпуске; - при необходимости перечень аналитических методик; - предлагаемые точки контроля в процессе производства и критерии приемлемости; - при необходимости дополнительные испытания, которые следует провести, вместе - с критериями приемлемости и валидацией аналитических методик; - план отбора проб; - методы регистрации и оценки результатов; - функции и обязанности; - предполагаемый график выполнения работ.
С помощью установленного процесса (используя компоненты, соответствующие спецификациям) можно произвести ряд серий готовой продукции при обычных условиях. Теоретически количество выполненных производственных циклов и сделанных наблюдений должно быть достаточным, чтобы позволить установить обычную степень изменчивости и тенденции, а также получить необходимое количество данных для оценки. Для валидации процесса считается достаточным выполнить три последовательные серии / цикла, при которых параметры находятся в заданных пределах. При этом размер серии при валидации должен быть равным размеру серии при промышленном выпуске продукции.
В исключительных случаях допускается начинать серийное производство до завершения программы валидации.
Похожие статьи
-
Валидация - Валидация фармацевтического производства
Валидация фармацевтика нормативный В России требования к валидации изложены в ряде нормативных документов, которые содержат общие подходы к процедурам,...
-
Основные понятия - Валидация фармацевтического производства
Валидация (Validation) - документированная процедура, дающая высокую степень уверенности в том, что конкретный процесс, метод или система будет...
-
Введение - Валидация фармацевтического производства
В настоящее время в мировой практике одним из важнейших документов, определяющих требования к производству и контролю качества ЛС для человека и...
-
Регламент является основным технологическим документом, устанавливающим технологические методы, технологические средства, нормы и нормативы для...
-
Биотехнологическая стадия - Производство биоферментных препаратов
Основной стадией является собственно биотехнологическая стадия, на которой с использованием того или иного биологического агента (микроорганизмов,...
-
1. Помещения и оборудование следует располагать, проектировать, строить, оснащать и эксплуатировать таким образом, чтобы они соответствовали проводимым...
-
ВР.1 Подготовка помещений, ампул, оборудования, персонала. По Белорусской Фармакопее к стерильным растворам предъявляются следующие требования:...
-
Вакцины и анатоксины ОФС.1.7.1.0004.15 - Производство биоферментных препаратов
Настоящая общая фармакопейная статья распространяется на иммунобиологические лекарственные препараты (ИЛП) - вакцины и анатоксины, содержащие компоненты,...
-
Введение - Технология производства пластырей
Актуальность темы исследования. Основными задачами фармацевтической технологии являются: разработка теоретических обоснований существующих методов...
-
В процессе производства раствора дезоксикортикостерона ацетата в масле 0,5% для инъекций химических превращений не происходит. Технологическая схема...
-
Государственное нормирование производства лекарственных препаратов представляет собой комплекс требований (узаконенных соответствующими документами) к...
-
Биокатализ и биотрансформация - Производство биоферментных препаратов
Процессы, в результате которых под действием микроорганизмов или ферментов происходит изменение химического состава исходного вещества При биокатализе -...
-
Правила GMP являются общим руководством, устанавливающим порядок организации производственного процесса и проведения контроля и содержащим минимальные...
-
Инъекционные лекарственные средства - это стерильные растворы, эмульсии или суспензии. Растворы для инъекций должны быть прозрачными и практически...
-
Развитие идеи И. И. Мечникова по целенаправленному изменению состава микрофлоры желудочно-кишечного тракта путем энтерального введения культур...
-
Для частичного или полного уничтожения микробов используют физические, химические, биологические или комплексные воздействия на них. Эффект от таких...
-
Коньяк - крепкий алкогольный напиток, обладающий специфическими цветом, букетом и вкусом, получаемый перегонкой молодых виноградных вин с последующей...
-
Санитария производства - Санитарно-микробиологический анализ мороженой рыбы
Согласно СанПин 2.3.4.050-96 "Производство и реализация рыбной продукции" на предприятии по производству мороженой рыбы действуют следующие правила по...
-
Основные способы приготовления обыкновенных пластырей - Технология производства пластырей
Чтобы получить хороший пластырь, все его ингредиенты должны быть лучшего качества, чистыми и сухими (без воды). Если в каких-либо составных частях,...
-
Фармакоэкономика - это экономическая оценка фармацевтических и биоинженерных продуктов, когда измеряют и сравнивают результаты лечения и затраты,...
-
Аптека Аптечная база (склад) Контрольно-аналитическая лаборатория База (склад) медицинской техники Магазин медицинской техники Магазин медицинской оптики...
-
Стадия биосинтеза антибиотика - Производство биоферментных препаратов
Это основная биологическая стадия сложного процесса получения антибиотического вещества. Главная задача на этой стадии -- создание оптимальных условий...
-
Люди, работающие на предприятии, должны разрабатывать технологическую и нормативную документацию, выполнять установленные в ней действия и/или оценивать...
-
Класс А -- особо чистые помещения; Класс Б -- чистые помещения; Класс В -- условно чистые помещения; Класс Г -- грязные помещения. Допустимые уровни...
-
Понятие и классификация пластырей - Технология производства пластырей
Пластырями называют препараты, применяемые исключительно наружно и отпускаемые или в виде массы, намазанной тонким слоем на коленкор, полотно, шелк,...
-
Иммуноферментный анализ - Производство биоферментных препаратов
Иммуноферментный анализ - это новый метод анализа, который используется с целью контроля в продуктах питания микотоксинов, гормонов, а также...
-
Биотехнологическое получение аминокислот - Производство биоферментных препаратов
Биотехнологическое получение аминокислот включает в себя прямую микробную ферментацию, а также микробиологический или ферментативный синтез из...
-
Строение растительной клетки - Производство биоферментных препаратов
Биотехнологический хемостат вакцина антибиотик Растительная клетка состоит из более или менее жесткой клеточной оболочки и протопласта. Клеточная...
-
Иммуноэлектрофорез - Производство биоферментных препаратов
(ИЭФ) -- метод исследования антигенного состава биологических материалов, сочетающий электрофорез и иммунодиффузию. Впервые описан Грабаром и Уильямсом в...
-
Особенности технологии производства каучуковых пластырей - Технология производства пластырей
Пластыри каучуковые изготавливают на основе синтетического и натурального невулканизированного каучука с добавлением смол, бальзамов, жироподобных и...
-
Паровой метод стерилизации осуществляют насыщенным водяным паром при избыточном давлении 0,11 МПа (1,1 кгс/кв. см) и температуре 120 град. С; 0,20 МПа (2...
-
Понятие "Стерильные лекарственные формы" Стерильные лекарственные формы - лекарственные формы полностью освобожденные от микроорганизмов. Определение...
-
На примере натрия хлорида Aq. pro injectionibus 600 ml 9*800/1000=7,2 В асептических условиях в стерильной подставке в 600 мл воды для инъекций...
-
Заключение - Технология производства пластырей
Фармацевтический лекарственный каучуковый пластырь Обобщим основные итоги работы по технологии приготовления пластырей. В процессе изготовления пластырей...
-
Спиртовое брожение - Процессы брожения и дыхания в технологии пищевых продуктов
Дыхание брожение аэробный Спиртовое брожение - это процесс превращения в анаэробных условиях сахара в диоксид углерода и этиловый спирт: С6 Н12О 6 >...
-
Особое значение имеет режим дня. При правильном и строгом его соблюдении вырабатывается четкий ритм функционирования организма. А это в свою очередь...
-
Введение - Отражение истории формирования фармацевтических знаний в музейных коллекциях
Большой интерес представляют китайская медицина и фармация. Собственная научная медицина и фармация возникли в Китае примерно за 1000 лет до нашей эры....
-
Вакуумный реактор. Вакуумный реактор - двутельный (трехслойный) пароварочный (элекрообогреваемый) закрытого типа с двигателем, редуктором, рамной...
-
Занятия трудом для учащихся 1 - 7 классов должны проводиться только в учебных классах, учебных мастерских или кабинетах обслуживающего труда, в которых...
-
Общая энтомология - теоретическая дисциплина, она служит научным фундаментом для перечисленных выше прикладных дисциплин. Общая энтомология изучает...
Квалификация - Валидация фармацевтического производства