Генотипирование генетических маркеров - Анализ ассоциаций tagSNPs и гаплотипов генов LEP и ACVR2A с развитием гестоза в популяциях русских и якутов
В данной работе исследовано 9 полиморфных вариантов 2 кандидатных генов подверженности к гестозу: рецептора активина 2 типа (ACVR2A) и лептина (LEP). В таблице 3 представлена характеристика изученных полиморфных вариантов в генах(рис 8, 9).
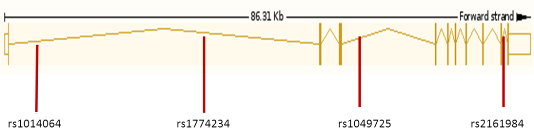
Рисунок 8 - Локализация изученных полиморфизмов в гене ACVR2A
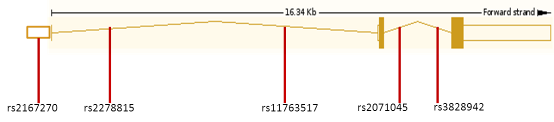
Рисунок 9 - Локализация изученных полиморфизмов в гене LEP
Таблица 3 - Характеристика исследованных полиморфизмов генов-кандидатов
|
Ген и его Локализация на хромосоме |
SNPs |
Замена |
Предковый аллель |
Локализация в гене (по данным базы NSBI) |
|
LEP 7q31.3 |
Rs2278815 |
A/G |
G |
1 Интрон |
|
Rs3828942 |
A/G |
G |
2 Интрон | |
|
Rs2167270 |
A/G |
G |
5'-UTR | |
|
Rs11763517 |
C/T |
T |
1 Интрон | |
|
Rs2071045 |
C/T |
T |
2 Интрон | |
|
ACVR2A 2q22.3 |
Rs1014064 |
A/G |
A |
1 Интрон |
|
Rs1774234 |
A/C |
A |
1 Интрон | |
|
Rs1049725 |
C/G |
C |
3 Интрон | |
|
Rs2161984 |
A/G |
G |
9 Интрон |
Генотипирование rs2278815, rs3828942, rs2167270 и rs11763517 гена LEP осуществляли с помощью амплификации соответствующих участков генома методом полимеразной цепной реакции (ПЦР) и анализа полиморфизма длин рестрикционных фрагментов (ПДРФ). Генотипирование проводили на амплификаторе Applied Biosystems (США). ПЦР проводили в объеме 15 мкл в микроцентри-фужной пробирке типа "Эппендорф" со следующими компонентами реакции: ДНК (2 нг), дезоксирибонуклеозидтрифосфаты в эквивалентных концентрациях 2 мМ, термостабильная ДНК-Taq-полимераза (0,8 е. а.), праймеры (прямой и обратный), буфер, содержащий сульфат аммония, MgCl2 (25 мМ), деионизованная вода. Реакция амплификации включает несколько стадий: на первом этапе происходит денатурация молекулы ДНК, далее отжиг праймеров, при котором они гибридизуются с комплементарными последовательностями на разных цепях, после чего следует элонгация - этап основного синтеза ДНК. В результате 30 и более циклов наблюдается экспоненциальное увеличение числа копий специфического фрагмента ДНК [Щелкунов]. ПЦР проводили по схеме: начальная денатурация - 94°С (5 мин), затем 42 циклa амплификации в следующих условиях: денатурация - 94°С (40 с), отжиг - 60°С (40 с), элонгация - 72°С (40 с), после чего пробы инкубировали 3 мин при температуре 72°С. Структура праймеров, температура отжига, эндонуклеазы рестрикции и размеры фрагментов исследованных полиморфных вариантов генов описаны в таблице 4.
Продукты амплификации и рестрикции анализировались с помощью электрофореза в 2%, 3 % агарозном геле и в 6%, 8% полиакриламидном геле, окрашенном бромистым этидием (рис. 10-13). Искомые бенды визуализировали в ультрафиолетовом трансиллюминаторе.
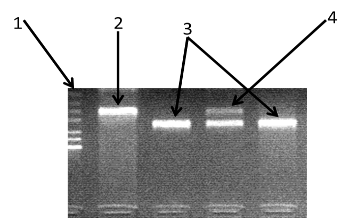
Рисунок 10 - Электрофореграмма разделения фрагментов ДНК амплифицированного участка rs2278815 гена LEP в 3% агарозном геле: 1 - маркер молекулярного веса pUC19/Msp I; 2 - гомозигота (AA); 3 - гомозигота (GG); 4 - гетерозигота
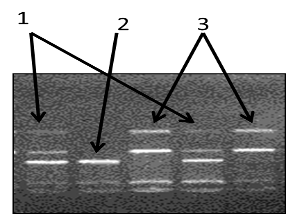
Рисунок 11 - Электрофореграмма разделения фрагментов ДНК амплифицированного участка rs3828942 гена LEP в 3% агарозном геле: 1 - гетерозигота; 2 - гомозигота (GG); 3 - гомозигота (AA)
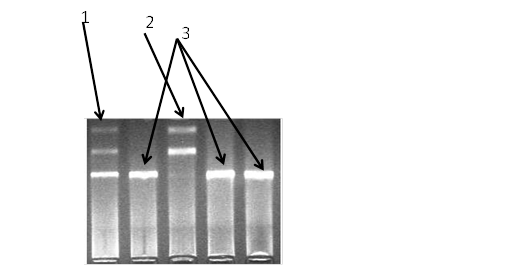
Рисунок 12 - Электрофореграмма разделения фрагментов ДНК амплифицированного участка rs2167270 гена LEP в 3% агарозном геле: 1 - гетерозигота; 2 - гомозигота (AA); 3 - гомозигота (GG)
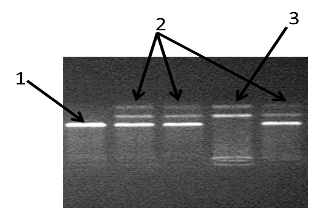
Рисунок 13 - Электорофореграмма разделения фрагментов ДНК амплифицированного участка rs11763517 гена LEP в 3% агарозном геле: 1 - гомозигота (TT); 2 - гомозигота (CC); 3 - гетерозигота
|
№ |
Локус |
Последовательность праймеров |
Температура отжига |
Эндонуклеазы рестрикции |
Температура рестрикции |
Длина фрагментов ДНК На электрофорезе |
|
1 |
Rs2278815 |
F: 5'-ATTCGCAGAGCTGAGATGC-3' R: 5'-CCCCCACCTCTACTCATCCT-3' |
60?С |
Bst4CI |
55?С |
Аллель А (209 и 49 п. о.) и аллель G (258 п. о.) |
|
2 |
Rs3828942 |
F: 5'-TCTTCAGCAGAGGCCATGTA-3' R: 5'-GCCAGTGTCTGGTCCATCTT-3' |
60?С |
RsaI |
37?С |
Аллель A (127 и 246 п. о.) и аллель G (373 п. о.) |
|
3 |
Rs2167270 |
F: 5'-GGAGCTGGCGCTAGAAATG-3' R: 5'-CAGCTCCCGGTAACCTTCT-3' |
60?С |
Bst4CI |
60?С |
Аллель A (189 и 110п. о.) и аллель G (299 п. о.) |
|
4 |
Rs11763517 |
F: 5'-TCTTCAGCAGAGGCCATGTA-3' R: 5'-GCCAGTGTCTGGTCCATCTT-3' |
60?С |
SmlI |
55?С |
Аллель С (228 и 131 п. о.) и аллель Т (373 п. о.) |
Таблица 4 - Структура праймеров, температура отжига, эндонуклеазы рестрикции и размеры фрагментов исследованных полиморфных вариантов генов
Геноипирование rs2071045 гена LEP, rs1014064, rs1774234, rs1049725 и rs2161984 гена ACVR2A осуществляли методом Real Time-PCR, воспроизводимым с помощью линейных разрушаемых проб TaqMan Genotyping Assay от Applied Biosystems. В данном подходе олигонуклеотид, комплементарный продукту ПЦР, метят флоурофором и гасителем флуоресценции (возможно использование как концевого, так и внутреннего мечения олигонуклеотида). В отсутствие мишени флоурофор и гаситель сближены и флуоресценция подавлена (обычно по механизму флуоресцентно-резонансного переноса энергии). При накоплении соответствующего продукта реакции, проба гибридизируется на ампликон, что ведет к ее разрушению за счет 5'- эндонуклеазной активности Taq-полимеразы (рис. 14) (Holland et al.,1991; Livak, 2003). Интенсивность сигнала возрастает с каждым циклом ПЦР пропорционально накоплению ампликонов (Holland et al.,1991; Happich et al., 2000). В данном походе принципиально использование полимеразы с хорошо выраженной 5'- эндонуклеазной активностью[44].
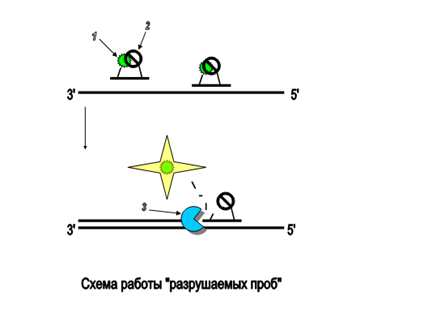
Рисунок 14 - Схема работы "разрушаемых проб": Пробы несут флуорофор (1) и гаситель флуоресценции (2). Пока проба находится в растворе, за счет близкого расположения, гаситель эффективно поглощает энергию флуорофора. В случае гибридизации со спецефическим продуктом реакции проба разрушается за счет 5'- эндонуклеазной активности полимеразы (3), что ведет к разобщению флоурофора и гасителя и возрастанию флоуресценции [44]. Таким образом, увеличение флуоресценции будет прямо пропорционально количеству наработанного ПЦР-продукта.
Для постановки TaqMan проб для исследуемых локусов готовили ПЦР смесь следующего состава (с расчетом на один образец ДНК=20 нг): готовая смесь для Real Time-PCR "Master Mix", включающая в состав дезоксирибонуклеозидтрифосфаты, термостабильную ДНК-Taq-полимеразу, буфер, содержащий сульфат аммония и MgCl2; флюоресцентные праймеры, меченные FAM и HEX; деионизированная вода. Реакция проходила в амплификаторе "BIORAD", включала в себя следующие стадии: начальная денатурация в течении 10 минут при температуре 95°С, затем протекала денатурария при 92°С в течении 15 секунд и элонгация при 60°С в течении 1 минуты (40 циклов).Продукты амплификации визуализировались с помощью программы "Biorad CSF Manager" и выглядели в виде схемы (рис. 15).
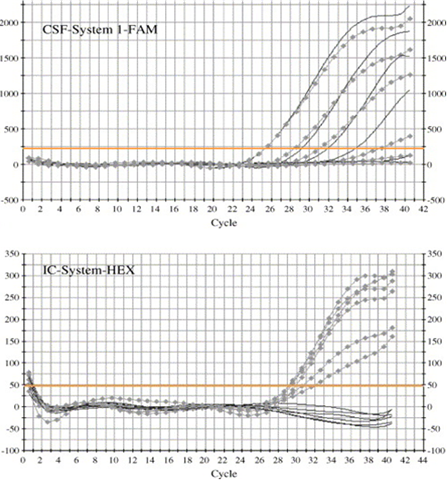
Рисунок 15 - Схема результатов Real Time-PCR
Похожие статьи
-
1) Провести анализ ассоциаций генотипов и аллелей исследованных полиморфизмов с гестозом в популяциях русских и якутов. 2) Оценить ассоциации...
-
Согласно одному из распостраненных определений, гестоз представляет собой синдром полиорганной недостаточности, возникающей при беременности, в основе...
-
Прогресс технологии генотипирования и разработка современных статистических методов предоставили новые возможности для изучения роли вариабельности...
-
Выделение ДНК из лейкоцитов венозной крови Выделение ДНК проводили стандартным методом с использованием фенол-хлороформной очистки [98, 120]. К 0.7 мл...
-
Семейный анализ сцепления Для гестоза полный геномный поиск (Genom-wide linkage studies) был проведен для пяти популяций на материале мультиплексных...
-
Ранняя диагностика и своевременная профилактика различных заболеваний являются одной из наиболее актуальных проблем современной медицины. Самую...
-
Одним из активно разрабатываемых направлений с применением технологии микрочипов является исследование транскрипционных профилей при сложных...
-
Полногеномный анализ ассоциаций tagSNPs с преэклампсией GWAS (Genom-wide association study) - полногеномный анализ ассоциаций позволяет выявить множество...
-
Клиническая характеристика обследованных пациенток Всего были обследованы 657 беременных женщин из двух популяций: якуты (г. Якутск) N = 340 и русские...
-
Лептин - гормон (белок 16 кДа), регулирующий энергитический обмен, оказывающий анорексигенное действие (рис. 6). Секретируется адипоцитами, клетками...
-
Клеточный сигнальный белок активин А - член суперсемейства сигнальных белков, таких как TGF-b (рис. 4). Роль этих белков была описана в различных...
-
Согласно современным исследованиям последних лет, генетическая компонента гестоза может составлять 50%. Изучение генетических маркеров, ассоциированных с...
-
Международный проект HapMap был создан и стартовал в 2002 году усилиями многих стран с целью каталогизировать индивидуальные генетические особенности...
-
Нами была проведена сравнительная оценка различных механизмов персистенции вируса в организме гусениц непарного шелкопряда и условия ее перехода в острое...
-
ДНК-маркеры - Методы исследования популяции человека
Для изучения структуры генофонда и этногенеза современных популяций человека в качестве первых молекулярно-генетических маркеров стали использовать...
-
Причины утомления: 1. В организме - 2. В мышце - в мышце во время сокращения накапливаются продукты обмена веществ (фосфорная кислота, молочная), которые...
-
Размножение и развитие - Биологическая характеристика черноморской хамсы
Размножение хамсы происходит практически по всей акватории Черного моря в водах с содержанием солей от 10-12‰ (Одесский залив) до 17-18‰ (большая часть...
-
Факторы популяционной динамики, Инбридинг - Генетические процессы в популяциях
Инбридинг Понятие "инбридинг" широко используется в популяционной генетике при описании особенностей генетической структуры популяций. Случайное...
-
Основной закон популяционной генетики - Генетические процессы в популяциях
Закон Харди-Вайнберга -- это ключевая закономерность популяционной генетики. Этот закон можно сформулировать следующим образом: в популяции бесконечно...
-
Генетические регистры - Методы исследования популяции человека
Определение распространенности максимально возможного числа нозологических форм наследственных заболеваний в популяции, возможно, путем создания...
-
Именно броуновское движение органических молекул в водной среде является причиной не только самоорганизации БС, но и их самовосстановления....
-
В настоящее время оценка генетической структуры различных популяций осуществляется с использование биологических и небиологических источников информации,...
-
Благодаря постоянному и беспорядочному броуновскому движению молекул воды [4] две идентичные по всем параметрам биомолекулы (БМ) способны не только...
-
Возбудители кишечного иерсиниоза и псевдотуберкулеза - Частная микробиология
Иерсиний псевдотуберкулеза Открыты Малассе и Виньялем в 1983 г. Морфология и физиология Y. pseudotuberculosis представляют собой грамотрицательныеные...
-
Метод полимеразной цепной реакции (ПЦР) - Перспективная наука геномика
В 1985 году К. Мюллис с сотрудниками разработали метод клонирования последовательностей ДНК in vitro, который получил название полимеразной цепной...
-
Материалы и методы. Обследовано 105 больных туберкулезом органов дыхания. Наряду с клинико-рентгенологическими и лабораторными обследованиями изучали...
-
При исследовании содержания аллелохемиков в листве интактных и поврежденных берез нами показано, что содержание оксибензойных кислот и простых...
-
Генетический скрининг взрослых - Геном человека
В настоящее время нет общенациональных программ генетического скрининга взрослого населения, но некоторые достижения заслуживают упоминания. Лучшим...
-
Вода - Анализ пищевых веществ, необходимых для организма человека
Вода играет важную роль в жизнедеятельности организма человека. Она является самой значительной по количеству составной частью всех клеток (2/3 массы...
-
В настоящее время в систематике бактерий осуществляется пересмотр сложившихся представлений, который благодаря своему бурному характеру и значению...
-
Углеводы - Анализ пищевых веществ, необходимых для организма человека
Это органические соединения, состоящие из углерода, водорода и кислорода, синтезирующиеся в растениях из углекислоты и воды под действием солнечной...
-
Количественный анализ экспрессии генов - Экспрессия генов
Количественный анализ экспрессии генов -- анализ транскриптома, измерение транскрипционной активности гена, с помощью определения количества его...
-
Полиморфные белки - Методы исследования популяции человека
Изучая генетическую структуру населения определенного региона проводятся исследования генетико-биохимического полиморфизма систем транспортных белков...
-
Половозрелым становится в возрасте 3-5 лет при достижении длины тела около 25 см и веса около 250 г. Задолго до нереста у самцов на теле появляются...
-
ЦИК + СЗ, С5 или AT локализуются на БМК клубочков Клеточная реакция: пролиферация мезангиоцитов, обладающих макрофагальными свойствами Образование...
-
Биологическими маркерами принято считать устойчивые биохимические, физиологические, анатомические и иные признаки организмов, варьирующие в норме в...
-
Механизмы генетической инактивации - Эффект положения гена
Почему при перенесении гена в окружение гетерохроматина происходит компактизация участка хромосомы и как следствие инактивация гена? Наиболее разумными...
-
Популяционная генетика - Генетические процессы в популяциях
Популяция (позднелат. populatio, от лат. populus -- народ, население) это совокупность особей одного вида, более или менее длительно занимающая...
-
Предмет генетической эпидемиологии, Генетическая эпидемиология - Генетические процессы в популяциях
Генетическая эпидемиология В середине 50-х годов 20 века оформилось новое научное направление - генетическая эпидемиология, которая реализуется при...
-
В историческом плане вопрос об эволюции генов является важнейшим, поскольку эволюция генов связана с истоками жизни вообще и ее совершенствованием в...
Генотипирование генетических маркеров - Анализ ассоциаций tagSNPs и гаплотипов генов LEP и ACVR2A с развитием гестоза в популяциях русских и якутов