Биоструктуры (БС), состоящие из двух идентичных субъединиц и одной биодобавки (БД), и их характеристики - Анализ этапов эволюции биоструктур до структур, способных объяснить большинство загадок зарождения генетических кодов. Часть 1
Благодаря постоянному и беспорядочному броуновскому движению молекул воды [4] две идентичные по всем параметрам биомолекулы (БМ) способны не только встретиться, но и объединиться (агрегировать) в одну - двухсубъединичную биоструктуру (БС) - первую по счету на длительном эволюционном пути различных БС.
При этом заметим, что объединиться в БС двум идентичным биосубъединицам помогает их амфипатичность, т. е. наличие двух разнокачественных групп в составе этих субъединиц - гидрофобной, избегающей контакта с молекулами воды, и гидрофильной. Данные группы субъединиц на рисунке 1 окрашены в голубой и синий цвет.
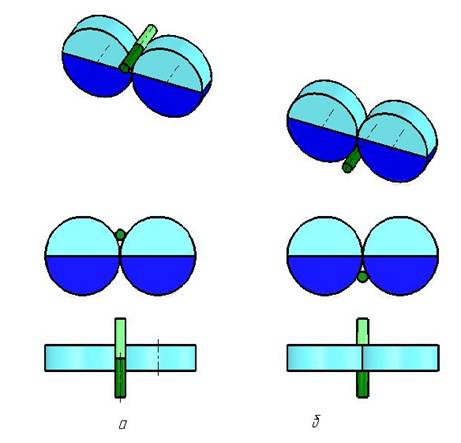
Рис. 1. Эволюционно первые биостуктуры (БС), состоящие из двух идентичных субъединиц и одной "биодобавки" (БД), изображенной на этом рисунке в виде удлиненного цилиндра
В результате такого взаимодействия двух субъединиц БС, образуются две симметрично расположенные биобухты (ББ). Они, возникают в результате соприкосновения образующих этих двух субъединиц данной БС.
В эти ББ благодаря тому же постоянному и беспорядочному броуновскому движению молекул воды могли не только попадать, но и на некоторое время задерживаться своеобразные "биодобавки" (БД) этих БС - различные химические элементы, получившие впоследствии название биоэлементов, и другие биомолекулы (БМ), меньшего поперечного сечения и иной плотности, чем субъединицы, создавшие БС.
Но зачем же понадобилась БД различным БС? Дело в том, что каждая из липидных молекул по отдельности была окружена молекулами воды, а при объединении этих субъединиц БС воедино, количество таких молекул воды уменьшалось. Следовательно, и тепловая защита субъединиц БС при этом уменьшалась. Чтобы восстановить ее величину, желательно было воспользоваться другими органическими веществами, имеющими более высокие значения температур плавления (Тпл.), а также использовать в качестве БД химические элементы, имеющие порою более высокие значения Тпл., чем у липидных субъединиц.
Действительно, Тпл. глицина 290°C, удельная теплота испарения ?528,6 Дж/кг, а у натрия - 97,8 °С и 97,9 кДж/моль. У кальция эти же характеристики - 837,85 °С и 153,6 кДж/моль, у воды удельная теплота испарения при 30 °С 2430 кДж/моль [3].
Поскольку в роли БД БС могут выступать как биомолекулы, так и химические элементы и их соединения. Напомним, что гидрофильностью обладают вещества с ионными кристаллическими решетками (оксиды, гидроксиды, силикаты, сульфаты, фосфаты, глины, стекла и др.), а также вещества органической природы со следующими полярными группами: - ОН, - СООН, - NO2 И другими [5]. Причем все они имеют разную величину плотности. биологическая субъединица генетический добавка
В этой связи отметим, что увеличение плотности слоя воды объясняется либо значительным отличием его температурных характеристик от окружающей воды (то есть термоклином), либо его повышенной соленостью.
Так, морская вода с соленостью 35 % при температуре 25 °С имеет плотность 1,02412 г/см3, в то время как чистая вода - 0,9971 г/см3. Различны у этих вод и точки замерзания: 0,00 °C - у чистой воды и -1,91 °C у морской при той же солености [7].
Благодаря нарастанию солености плотность воды увеличивается от экватора к тропикам, а в результате понижения температуры - от умеренных широт к Полярным кругам. Зимой происходит опускание полярных вод и их движение в придонных слоях к экватору, поэтому глубинные воды Мирового океана в целом холодные, но обогащенные кислородом.
Под действием силы тяжести, под влиянием ветра, притяжения Луной и Солнцем и других факторов происходит движение воды. При движении вода перемешивается, что позволяет равномерно распределяться водам с разными показателями солености, химического состава и температуры [8].
Вследствие этого, если в качестве таких БД выступали аминокислоты, то сразу же становится понятным, что их первичный и самый строгий отбор осуществлялся с помощью только двух субъединиц первичной БС.
В таком случае уже эти первые БС, состоящие из двух взаимодействующих нуклеотидов, могли невольно для себя начать отбор аминокислот для будущего использования их в строительстве белков, и это обстоятельство непосредственно отразилось затем на роли первых двух нуклеотидов в трехнуклеотидном кодоне.
В то же время симметричность расположения двух ББ в первой БС, невольно разделяла их БД на две большие группы, а использование в качестве такой БД аминокислот заложило еще и такие свойства генетического кода как симметричность кодонов и их комплементарность.
В связи с этим отметим, что именно наличие сразу двух ББ, неизбежно способствовало разделению аминокислот, выбранных БС, на две большие группы. Это обстоятельство, в свою очередь, привело к наличию двух классов аминоацил-тРНК-синтетаз (АРСаз, aaRS, аа-тРНК синтетаза, фермент КФ 6.1.1) - важнейших ферментов внерибосомного этапа белкового синтеза, осуществляющих реализацию генетической информации и в сумме составивших 20 единиц.
Каждая АРСаза специфична только по отношению к одной из 20 аминокислот, входящих в белки, и к одной или нескольким тРНК [1].
Первый класс АРСаз включает ферменты, катализирующие синтез аминоацил-тРНК следующих аминокислот: аргинин (Арг, Arg, R, C6H14N4O2, 1,1 г/смі), валин (Вал, Val, V, C5H11NO2, 1,230 г/смі), глутамин (Глн, Gln, Q, C5H10N2O3), глицин (Гли, G, Gly, C2H5NO2, 1,607 г/смі), изолейцин (Иле, Ile, I, C6H13O2N), лейцин (Лей, Leu, L, C6H13N1O2, 1,191 г/смі), метионин (Мет, Met, M, C5H11NO2S, 1,340 г/смі), тирозин (Тир, Tyr, Y, C9H11NO3, 1,456 г/смі), триптофан (Три, Trp, W, C11H12N2O2), цистеин (Цис, Cys, C, C3H7NO2S) [3].
Второй класс АРСаз включает ферменты, катализирующие синтез аминоацил-тРНК следующих аминокислот: аланин (Ала, Ala, A, C3H7NO2, 1,424 г/смі), аспарагин Асн, Asn, N C4H8N2O3, 1,346 г/см 3), аспарагиновая кислота (Асп, Asp, D, C4H7NO4, 1,67 г/смі), гистидин (Гис, His, H, C6H9N3O2), глицин (Гли, G, Gly, C2H5NO2, 1,607 г/смі), лизин (Лиз, Lys, K, C6H14N2O2), пролин (Pro, Про, P, C5H9NO2, 1,186 г/смі), серин (Сер, Ser, S, C3H7N1O3, 1,537 г/смі), треонин (Тре, Thr, T, C4H9NO3), фенилаланин (Фен, Phe, F, C9H11NO2, 1,29 г/смі) [3].
Причем оказалось, что АРСазы 1-го класса обеспечивают перенос аминоацильной группы сначала ко второй 2'-ОН-группе терминального остатка адениловой кислоты, затем перемещение ее к 3'-ОН-группе (путем реакции трансэтерификации), в то время как ферменты 2-го класса катализируют перенос аминоацильной группы непосредственно к 3'-ОН-группе концевого аденилового нуклеотида.
Принято считать, что в добелковой жизни (РНК-мире) функцию АРСаз, участвующих в синтезе белка, выполняли, по всей видимости, рибозимы, то есть молекулы РНК, обладающие каталитическими свойствами [1].
В таком случае, вполне вероятно, что на первом этапе создания рибосом, их две половинки были почти идентичными, как и два соседних домена у различных доменных белков, цепи которых используются в современных ферментах и рецепторных белках.
В этой связи напомним, что белковый домен представляет собою компактную глобулу, способную существовать или сама по себе, или входить в состав более крупного белка наряду с другими доменами [2].
Однако не только образующие двух доменов могли образовывать ББ. Эволюционно ранее ББ могли образовываться в виде изгибов даже небольшой белковой цепи (например, трипептида). А для создания таких резких изгибов как нельзя лучше подошла аминокислота пролин, обладающий 4-мя кодонами-синонимами (кодонами одной серии): CCU, CCC, CCA, CCG), синтезирующийся в организме из глутаминовой кислоты.
В составе белков атом азота пролина не связан с атомом водорода, таким образом, пептидная группировка X-Pro не может быть донором водорода при формировании водородной связи. Вследствие этого в местах локализации пролина, обладающего конформационно жесткой структурой, возникают неполноценные пептидные связи, и полипептидная цепь образует изгибы и зигзаги.
Данное свойство пролина очень пригодилось при создании рецепторных белков, обычно имеющих несколько доменов, поскольку эта аминокислота играетважную роль при образовании третичной структуры белка. Так, участки белков с высоким содержанием пролина часто формируют вторичную структуру полипролиновой спирали II типа [12].
В клетках мозга из пролина синтезируется глутамат - важнейший нейромедиатор. L-пролин содержится во всех природных белках. Особенно богаты им растительные белки - проламины, белки соединительной ткани (10-15 % в коллагене), в-казеин. L-Pro входит в состав инсулина, адренокортикотропного гормона, грамицидина С и других биологически важных пептидов. Попутно заметим, что D-пролин входит в состав некоторых алкалоидов.
Без этой аминокислоты восстановление тканей было бы невозможно, поскольку пролин дегидрогеназа - важный фермент, который задействован в апоптозе (естественной смерти клетки), во многом тем самым способствующем обновлению клеток тканей и органов.
Поскольку в качестве БД двухсубъединичных БС могут выступать не только аминокислоты, но и химические вещества, отобранные их ББ, представляют чрезвычайный и несомненный интерес следующие факты, указывающие на непосредственное и сложное влияние одних разновидностей БД на другие разновидности БД в одной и той же БС.
Это обстоятельство, в свою очередь, привело к появлению у катализирующих БС активаторов (увеличивающих скорость каталитической реакции) и ингибиторов.
Невольным подтверждению этого вывода являются следующие факты.
В последнее годы стало известным [13], что пролин активно синтезируется на заключительной стадии созревания винограда. Причем повышенное содержание пролина обнаружено в винограде, выращенном при недостатке в почве бора и марганца, а пониженное - при дефиците цинка и молибдена.
Известно также, что пролин дегидрогеназа обеспечивает возможность создания супероксида (надпероксида) - активных, богатых электронами кислородных частиц. Супероксид, в свою очередь, вовлечен в процесс разрушения поврежденных клеток и играет важную роль в предотвращении развития и распространения раковых опухолей.
Примечательно, что обычно пролин дегидрогеназа передает электроны в митохондриальную мембрану, не позволяя им соприкасаться с кислородом для создания реактивных молекул супероксида.
Попутно отметим, что митохомндрия-двумембранная гранулярная или нитевидная органелла толщиной около 0,5 мкм. Митохондрия, характерная для большинства эукариотических клеток, как автотрофов (фотосинтезирующие растения), так и гетеротрофов (грибы, животные), отсутствует у бактерий.
Если в клетке нарушается работа митохондрий, то они переключаются на другой путь получения энергии - гликолиз. При этом образуется молочная кислота, разрушающая коллагеновый матрикс, соединяющий клетки между собой. В результате этого часть таких клеток, способна покинуть свое место и перемещаясь в организме, образовывать опухоли в других частях тела - метастазы.
Вышеприведенные факты наглядно показали всю важность роли аминокислот в качестве БД БС и их сложной связи с другой разновидностью БД - биоэлементами.
Но не менее важно и влияние свойств субъединиц БС на БД. В этой связи обратим внимание на тот факт, что любая БД, попавшая в ББ, из-за сопротивления внешней среды и своей инерции при передвижении БС вперед всегда опирается больше на вторую субъединицу (от ее начала), чем на первую. В результате такого взаимодействие с нею и свойства данной БД будут зависеть от этой (второй) субъединицы БС гораздо существеннее, чем от иной ее субъединицы.
Это обстоятельство приводило к тому, что две описанные выше группы аминокислот, в свою очередь, должны были разделиться на подгруппы, меньшие по числу.
Действительно, согласно установленным фактам генетического кода, все кодоны с цитозином (С) во втором положении кодируют аминокислоты (Ser, Pro, Thr и Ala), малые по размеру, а все кодоны с урацилом (U) во втором положении кодируют аминокислоты разных (но не крайних) размеров с гидрофобной (неполярной) боковой цепью - Рhе, Lеu, Ilе, Меt и Vаl.
Если исключить терминирующие кодоны, то наличие аденина (А) во втором положении определяет полярную или заряженную боковую цепь аминокислот (Туг, Нis, Glп, Аsп, Lуs, Аsр и Glu), немалых по размеру.
Тогда с гуанином (G) во втором положении таких БС могли взаимодействовать следующие их "биодобавки": самая реактивная аминокислота (Cys), самая большая и плоская (Trp), самая большая и корявая (Arg), самая маленькая (Gly), часть единственной несвязной серии (Ser) и неоднозначный терминальный нонсенс (UGA), который в ряде случаев кодирует 21-ю аминокислоту - селеноцистеин (Sec) [14].
При этом, порою, могла изменяться и суммарная величина заряда такой новой БС.
Данное свойство БС было связано с тем, что головки липидных молекул всегда либо отрицательно заряжены, либо нейтральны. А поскольку ББ образуют две таких молекулы, становится понятным, почему в число биогенных химических элементов, в первую очередь, отбирались ионы металлов с зарядом +2е.
Попутно заметим, что в физиологических условиях отрицательный заряд нуклеотидов на единицу больше числа фосфатных остатков в молекуле. Благодаря этому обстоятельству третичная структура РНК стабилизируется ионами двухвалентных металлов, например, ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями [3].
Обратим также особенное внимание на тот факт, что такая БС наделялась и новыми дополнительными свойствами, в первую очередь, большей чувствительностью к изменениям внешней среды, чем, если бы она не имела БД. И тут первую роль могли играть только лишь аминокислоты, а не биохимические элементы, поскольку все аминокислоты - амфотерные соединения, способные проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы - СООН, так и основные свойства, обусловленные аминогруппой - NH2.
Общеизвестно, что при нейтральных значениях рН среды все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы аминокислот находятся в диссоциированном состоянии [3]. Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд.
Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, - положительный заряд.
Изменение рН в кислую сторону (т. е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп.
В сильно кислой среде все аминокислоты приобретают положительный заряд. Напротив, увеличение концентрации ОН - групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда.
В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд. Таким образом, в кислой среде аминокислоты существуют в виде катионов, а в щелочной - в виде анионов.
Описанные выше обстоятельства непосредственно и повлияли на включение в БС аминокислот, поскольку они заметно различаются по строению, размерам и физико-химическим свойствам своих радикалов. Так, по химическому строению радикала они делится на алифатические, ароматические и гетероциклические. А в составе алифатических радикалов, в свою очередь, могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH2), тиольная (-SH), амидная (-CO-NH2), гидроксильная (-ОН) и гуанидиновая группы [9].
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные (гидрофобные) ее отталкивают). Вследствие этого наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
Обратим внимание еще на одну особенность аминокислот, выбранных БС в качестве БД.
Часть этих аминокислот не только способна превращаться в себе подобных (т. е. в заменимые аминокислоты), но и участвовать в создании субъединиц БС - липидов (Phe, Tyr, Leu, Lys и Trp) и нуклеотидов.
Так, молекула аспарагиновой кислоты (Асп, Asp, D) образует существенную часть скелета пуриновых и пиримидиновых ядер. С метаболизмом Gln связаны эти же разновидности нуклеотидов. Помимо этого, синтез пуринов связан с метаболизмом аминокислоты Gly.
БД (в виде аминокислот) попадает в ББ данной БС, если значения плотностей ее и субъединиц БС отличаются на немного. Для того, чтобы аминокислота могла попадать во все без исключения ББ (как верхние, так и в нижние), ее плотность должна быть несколько меньше, чем у идентичных субъединиц БС.
Данный вывод можно подтвердить значениями следующих плотностей БС, проставленных в круглых скобках, в биоструктурах с 4-мя ББ, в которых каждые две ББ полностью идентичны.
Такими БС являются: кодон UUU (1,32), кодирующий Phe (1,29); кодон GGG (2,2), определяющий Gly (1,607) и кодон CCC (1,55), кодирующий аминокислоту Pro (1,367).
Характерна эта закономерность и для других БС, например: кодоны UUG (1,32+1,32 +2,2)/3 и UUA (1,32+1,32+ 1,662)/3 кодируют Leu (1,293).
Таким образом, прослеживается явная тенденция в разнице между величинами плотностей субъединицы и ее БД (если в качестве ее используются аминокислоты) - она всегда меньше плотности субъединиц БС. Эта же зависимость особенно четко прослеживается для величин плавучей плотности данных веществ, несколько отличающейся от плотности этих веществ, находящихся в кристаллическом виде.
Но в таком случае также можно предположить, что изначальное появление двух взаимодействующих участков нуклеиновой кислоты (РНК-РНК: шпильки в тРНК и в мРНК, появление двухцепочечных РНК, гибридов РНК-ДНК и двуцепочечной ДНК) было связано именно с созданием дополнительных ББ, в которые могли попадать дополнительные БД, изменяющие значения плавучей плотности данной БС.
В этой связи можно предположить, что наличие в тРНК 4-х "стеблей", содержащих участки двух цепей РНК с аминокислотами, вставленными в их "сборные" ББ, было обусловлено стремлением уменьшить разницу в значениях плавучей плотности АРС-азы с аминокислотой и тРНК определенного кодона.
Благодаря разности плотностей субъединиц и БД, такая БС могла подниматься либо вверх (если плотность БД меньше, чем у ее субъединиц), либо опускаться вниз, когда плотность БД (в виде биохимических элементов) была больше, чем у субъединиц БС.
Данная разница в величинах плотностей обязательно скажется не только на величине, получаемой БС космической энергии, но и на ее взаимодействии с другими БС.
Это обстоятельство также логично объясняет причину не только включения в состав БД различных БС целого перечня ионов тяжелых металлов: железо, медь, цинк, молибден, титан и другие, но и их комбинаций.
Например, фермент энолаза, множественные формы которой (изоферменты) характерны для тканей рыб, активируется ионами магния (Magnesium, Mg, 12, 1,738 г/смі) - Mg2+; марганца (Manganum, Mn, 25, 7,21 г/смі) - Mn2+, калия (Kalium, K, 19, 0,856 г/смі) - К+, и инактивируется ионами фтора (Fluorum, F, 9, (при - 189°C) 1,108 г/смі). Фторид (Fluoride) - это ион фтора - F-1 [20].
Для энолазы характерна доменная структура. В глубокой щели между малым N-концевым и большим С-концевым доменами располагается активный центр фермента. Для проявления каталитической активности необходимы ионы Mg, причем без них фермент не только не обладает активностью, но и диссоциирует на субъединицы.
При увеличении концентрации меди в воде, которую пили животные, замечено следующее: наибольшее количество меди связывается в цитозоле, значительный рост концентрации меди отмечается и в митохондриях. Увеличенное поступление меди приводит к перераспределению биогенных элементов, в результате чего в клетках почек снижается содержание цинка и магния, а увеличивается - кальция.
Изменение концентрации биогенных элементов, безусловно, влияет на активность многих ферментов и, в конечном итоге, на обмен веществ в почечной ткани. Можно предположить, что существенно изменится липидный обмен, так как многие ферменты, участвующие в метаболизме липидов, цинк - и магний-зависимые [21].
Поскольку в данном разделе работы рассматривается роль БС с абсолютно идентичными субъединицами в создании генетического кода, отметим, что повторяющиеся последовательности и сателлитная ДНК - одна из закономерностей в чередовании нуклеотидов у большинства ДНК эукариотических клеток. Эти ДНК состоят из уникальных и частично повторяющихся последовательностей, составляющих порою (у мыши) десятую долю генома.
Имея другую величину плавучей плотности, ДНК с повторяющимися последовательностями при центрифугировании в градиенте плотности CsCl образует отчетливую сателлитную полосу. Каждая из двух цепей этой ДНК настолько отличается по составу оснований, что они хорошо разделяются в растворе CsCI [11].
Таким образом, с большой долей достоверности можно говорить о том, что экзоны пре-мРНК, кодирующие белки участки нуклеиновых кислот, представляют собой участки непосредственной связи ДНК и РНК, имеющие значения плотностей, отличной от плотности основной массы ДНК.
При объединении субъединиц цепей ДНК и РНК также будут образовываться ББ, в которые могут попасть аминокислоты. Затем, при расхождении этих двух взаимодействующих участков нуклеиновых цепей, аминокислоты, попавшие в их "сборные" ББ, могут активно подбираться аминоацил-ТРК-синтетазами и уже в комплексе с тРНК доставляться к рибосоме и мРНК для синтеза белка.
Попутно напомним, что последовательно соединенные экзоны и составляют мРНК эукариот. Отметим также, что некоторые молекулы мРНК также могут катализировать сплайсинг экзонов без участия белков.
У некоторых вирусов, например, пикорнавирусов, мРНК образует весь их геном.
Напомним, что и основной носитель энергии в клетках - аденозинтрифосфамт (нуклеозидтрифосфат, сокр. АТФ, англ. АТР, C10H16N5O13P3, 1,04 г/см3) - рибонуклеотид, а для начала процесса удвоения ДНК также необходима - БС, содержащая РНК. Это - РНК-"затравка" (праймер) [3].
Теперь становится понятной и причина различия в величинах плавучих плотностей различных ДНК и РНК, а также их гибридов ДНК-РНК [9], сделавших возможным жизнь на Земле.
Кроме того, становится понятным и частая связь нуклеиновых кислот с различными белками. Ведь величина плавучей плотности белков в растворах CsCl колеблется в пределах 1,3-1,33 г/см3, а у РНК - более 1,9 г/см3.
У ДНК показатель плотности находится в пределах 1,7 г/см3. Это связано с тем, что в ДНК нуклеотид урацил с плотностью 1, 32 г/см3 заменен тимином, имеющим плотность 1,23 г/см3.
Для того чтобы лучше понять значение этого факта для различного рода БС, мысленно заменим воздух в следующем примере на тимин, подводную лодку - на БС, а ее баки - на ДНК, гуанин - на воду:
Регулируя количество воды в балластных танках (баках), подводная лодка может зависать на желаемой глубине, плотность воды на которой равна средней плотности подводной лодки. Если набрать в танки больше воды, вытеснив соответствующее количество воздуха, то плотность подводной лодки увеличивается, и она погружается, попадая в слои более холодной воды с большей плотностью. Когда плотность воды оказывается равной плотности подводной лодки, лодка снова зависает на новой глубине [7].
Таким образом, тимин невольно способствовал не только дальнейшему объединению РНК с ДНК, но и резкому увеличению территориального распространения использующих его БС, т. е. резкому увеличению ариала всех ДНК-овых организмов и выходу их из воды на сушу.
ДНК, содержащаяся в хлоропластах, - кольцевая, по плотности обычно несколько отличная от ядерной ДНК. Например, у Euglena gracilis плотность ядерной ДНК составляет 1,707 г/смі, а ДНК из хлоропластов - 1,685 г/смі [10].
Анализ приведенных данных свидетельствует о том, что поскольку с белковыми структурами гораздо легче взаимодействовать именно ДНК, а не РНК, то и ДНК-овый хроматин будет обладать большей стабильностью и характеризоваться большим разнообразием.
Интересно, что при этом цепи двухцепочечных нуклеиновых кислот могут выступать в роли двух субъединиц БС, образующих биобухты (ББ), носящие название "бороздки". Причем их также будет именно две, как и у любой двухсубъединичной БС.
В структуре двуцепочечной ДНК, находящейся в В-форме, различают две бороздки - большую, шириной 2,2 нм, и малую, шириной 1,2 нм. У А-формы ДНК глубокая и узкая большая бороздка и неглубокая и широкая малая бороздка.
Важная структурная особенность РНК, отличающая ее от ДНК - наличие гидроксильной группы в 2' положении рибозы, которая позволяет молекуле РНК существовать в А, а не В-конформации, наиболее часто наблюдаемой у ДНК.
Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина.
Вероятно, именно эта особенность нуклеиновых кислот и способствовала созданию "раздетых" вирусов, т. е. содержащих только нуклеотид с белковыми субъединицами - капсомерами.
Фрагменты двойной спирали РНК также образованы ее комплементарными участками, расположенными в пределах одной цепи. В некоторых случаях доля двухспиральных участков в РНК может достигать 75-90 %. Вероятно, именно это обстоятельство и способствовало появлению двухцепочечных РНК-вирусов.
Подавляющее большинство вирусов являются РНК-содержащими. Вирусы растений чаще всего содержат одноцепочечную РНК, а бактериофаги, как правило, обладают двухцепочечными ДНК.
Названия цепей ДНК для вирусов, содержащих одноцепочечную ДНК, сходны с таковыми для РНК: кодирующая цепь комплементарна мРНК (-), а некодирующая является ее копией (+). Однако геномы нескольких типов ДНК - и РНК-содержащих вирусов представлены молекулами, имеющими различную полярность, то есть транскрипции может подвергаться любая цепь. Таковы, например, геминивирусы-вирусы растений, содержащие одноцепочечную ДНК, и аренавирусы - вирусы животных с одноцепочечной РНК.
Изучение нуклеотидного состава ДНК различных организмов показало, что соотношение пар азотистых оснований А+Т/G+C является важным показателем специфичности ДНК у разных организмов. Так, у человека оно составляет 1,52, у овцы -1,36, у бактерии Е. coli -0,93, у возбудителя газовой гангрены C. Perfringens - 2,70 [9].
Поскольку вначале создавались БС с достаточно большей величиной плавучей плотности, скорее всего жизнь на Земле зарождалась не в приповерхностных водах, а на достаточно больших глубинах и неподалеку от источника происхождения ее составляющих - идентичных субъединиц и БД, т. е. возле длительно действующих подводных вулканов.
В этой связи обратим внимание на следующие общеизвестные факты.
Даже прозрачная вода рассеивает, преломляет и поляризует свет нашей ближайшей звезды - Солнца. Следовательно, неорганическая и органическая взвесь продуктов извержения такого подводного вулкана могла длительное время не только поляризовать преломленный свет, проникающий на эти глубины, но и усиливать его полярность.
Астробиолог Джереми Бэйли (Jeremy Bailey) теоретически доказал, что в ультрафиолетовом и даже видимом диапазонах звездный свет также может приобретать круговую поляризацию после рассеяния на частицах пыли. При этом если право - и левополяризованная компоненты ультрафиолетового излучения окажутся пространственно разделены, то в соответствующих участках молекулярного облака будут разрушаться молекулы аминокислот одного определенного типа зеркальной симметрии. При этом свет, поляризованный по часовой стрелке (если смотреть навстречу лучу), губительно воздействует на D-молекулы, а поляризованный против часовой стрелки, наоборот, разрушает только L-аминокислоты [18].
Наша планета, в отличие от Венеры и Урана, вращается в ту же сторону, что и Солнце. В таком случае солнечный свет, поляризованный по часовой стрелке, в воде мог постоянно увеличивать концентрацию именно L-аминокислот и уменьшать концентрацию липидных молекул.
В этой связи молекулы сахаров и нуклеотидов, как и липиды, относящиеся к D-ряду веществ, могли увеличивать свою концентрацию только лишь под липопротеиновой пленкой с большой долей аминокислот, т. е. под наружной мембраной БС.
Вполне возможно, что именно БД в виде аминокислот способствовали укрытию липидных БС от губительного для них воздействия поляризованного света Солнца. Тогда даже неспецифическое и случайное создание белков-дипептидов приветствовалось БС и способствовало в последствии созданию трансляционного аппарата клетки.
Теперь становится понятным не только выбор L-аминокислот различными БС, но и тот факт, что белковые структуры, в массовом количестве присутствуют именно на внешней поверхности липидного бислоя. Процентное соотношение белка к липидам в мембране: бактерий составляет 55-65/10-20, хлоропластов - 50-60/40-50, ядра - 48-52/38-47. митохондрии - 60-65/ 35-40, эритроцита - 60/40, седалищного нерва - 20-40/60-80 [3]. биологическая субъединица генетический добавка
Липиды составляют 10-20 % от массы тела человека. В теле взрослого человека содержится 10-12 кг липидов, из которых 2-3 кг приходится на структурные липиды. Подавляющая часть резервных липидов (до 98 %) сосредоточена в жировой ткани. Нервная ткань содержит до 25 % структурных липидов, а биологические мембраны - 40 % (от сухой массы) [3].
Соотношение жиров (липидов) и белков в липопротеидах различно.
Минимальное количество белка содержится в хиломикронах (0,96 г/см 3).
Холестерин (холестерол, C27H46O) - стабилизатор текучести плазматической мембраны имеет плотность 1,05 г/смі. К периферийным тканям холестерин транспортируется хиломикроном, ЛПОНП и ЛПНП. К печени, откуда затем холестерин удаляется из организма, его транспортируют аполипротеины группы ЛПВП.
Отметим также, что липиды тоже связываются с ДНК, причем связывание всех жирных кислот с малой бороздкой ДНК сильнее, чем с большой [3].
Теперь остается обратить более пристальное внимание еще на одно свойство воды, поспособствовавшее выбору веществ, используемых БС.
В этой связи напомним, что высокие градиенты плотности (пиноклин) на глубине 70-90 м препятствует подъему богатых питательными солями глубинных вод в зону фотосинтеза [15]. Следовательно, для повышения плотности цитоплазмы клеток с фотосинтезом БС необходимо было задействовать иные вещества, чем соли, например, сахара.
В то же время появление сахаров внутри липидной оболочки могло способствовать образованию сахаров нуклеотидов и созданию вначале РНК, а затем и ДНК.
Поскольку жизнь зародилась в водной среде, в цитоплазме и крови также много воды. Плотность основной среды цитоплазмы клетки - гиалоплазмы колеблется в узких пределах от 1,025 до 1,055 г/мл и подобно плотности крови зависит от содержания в ней форменных элементов, белков липидов и различных полисахаридов. Попутно отметим, что у человека плотность крови составляет 1,060-1,064 г/мл.
Норма глюкозыу детей до 14 лет - 3,33-5,55 ммоль/л, у взрослых норма глюкозы в крови - 3,89-5,83 ммоль/л. С 60 лет уровень глюкозы в норме возрастает до 6,38 ммоль/л. При беременности глюкоза в норме - 3,3-6,6 ммоль/л.
Изменение величины плотности растворов сахарозы в воде (г/мл) при разных концентрациях этого вещества (%) имеет следующий вид: 1,020 (5 %), 1,041 (10 %), 1,062 (15 %), 1,084 (20 %), 1,107 (25 %), 1,131 (30 %) [17].
Учитывая вышеприведенные факты, можно высказать предположение о том, что изначально различные сахара были отобраны из окружающей среды первичными липидными мембранами только для того лишь, чтобы повысить плотность внутриклеточной среды и облегчить тем самым передвижение биосубъединиц как липидных, так и нуклеиновых БС, собранных под их защитой. Таким образом, различные сахара являются не только субстратами окислительных реакций, но и сами по себе, своим лишь присутствием в цитоплазме клеток, способствуют лучшей работе разнообразных катализирующих структур.
И не это ли свойство сахаров - ростообразующий фактор всех без исключения БС - в настоящее время непосредственно связывают с инсулином, являющимся основным гормоном поджелудочной железы?
Инсулин - основной анаболический (укрепляющий ткани) гормон обмена веществ, контролирующий многие аспекты регулирования глюкозы, отложение жиров в организме и множество других функций. При его недостатке уровень глюкозы в крови повышается, клетки голодают. Это связано с тем, что инсулин необходим при доставке глюкозы из крови к клеткам, которые должны использовать ее как топливо для существования и для отложения глюкозы в жировых клетках в качестве триглицеридов при потреблении энергии в будущем. Но, в отличие от анаболического действия тестостерона, используемого для строения мышц и костей, инсулин - анаболический гормон, накапливающий жир.
Инсулин - это очень мощный источник образования жира (липогенез) и очень сильный ингибитор расщепления жира (липолиз). Инсулин действительно оказывает действие на увеличение соотношения жира и мышц, поэтому, чем больше инсулиновой стимуляции, тем меньше мышечных клеток, сжигающих жир. Избыток инсулина - неизбежная расплата, если у вас проблемы с лишним весом [6].
Чистая глюкоза может напрямую усваиваться, например, мозгом и мышцами. На уровень глюкозы реагируют мозг и другие органы, вырабатывающие "гормоны сытости". С глюкозой же связана и работа поджелудочной железы, вырабатывающей инсулин - гормон, отвечающий за всасывание глюкозы тканями и снижение ее концентрации в крови.
Теперь во многом становится понятной фраза: "Сахар - белая смерть".
Высокая концентрация сахаров во внутриклеточном пространстве обязательно приведет к значительному росту плотности цитоплазмы, что, в свою очередь, затруднит перемещение субъединиц, катализирующих БС.
В то же время остановка работы ферментов неизбежно приводит к коме и, зачастую, к смерти, т. е. к прекращению жизнедеятельности организма.
Чем же так опасна для человеческого организма кома? Кома (от греч. к?мб - глубокий сон) - угрожающее жизни состояние, характеризующееся потерей сознания, резким ослаблением или отсутствием реакции на внешние раздражения, угасанием рефлексов до полного их исчезновения, нарушением глубины и частоты дыхания, изменением сосудистого тонуса, учащением или замедлением пульса, нарушением температурной регуляции.
Приведенная характеристика этого опаснейшего состояния организма однозначно свидетельствует о нарушениях в работе многочисленных катализирующих и переносящих БС, начавших свой эволюционный путь со встречи двух идентичных субъединиц и БД, попавших в ББ, созданных образующими этих субъединиц.
Похожие статьи
-
Именно броуновское движение органических молекул в водной среде является причиной не только самоорганизации БС, но и их самовосстановления....
-
Обмен белков - Питательные вещества
После расщепления белков в пищеварительном тракте образовавшиеся аминокислоты всасываются в кровь. В кровь всасывается также незначительное количество...
-
В историческом плане вопрос об эволюции генов является важнейшим, поскольку эволюция генов связана с истоками жизни вообще и ее совершенствованием в...
-
Обмен белков - Роль белков в организме
Аминокислоты, образовавшиеся после расщепления белков в пищеварительном тракте, всасываются в кровь. В кровь всасывается также незначительное количество...
-
Геном пластид - Генетика пластид
В 1961 году X. Рис и В. Плаут обнаружили, что участок хлоропласта в одноклеточной водоросли хламидомонады окрашивается положительно по Фельгену. При...
-
Физиологическая роль белка, Структурная функция белка - Строение, функции и значение белков
Структурная функция белка Белки сложные органические соединения, построенные из аминокислот. В состав белковых молекул входят азот, углерод, водород и...
-
Сшивки с белками - Фотохимические превращения ДНК. Люминесцентные метки и зонды
При наличии на поверхности носителя функциональных групп, способных вступать в химические реакции с функциональными группами фермента с образованием...
-
Химическая эволюция - Зарождение жизни в горячей воде
Химическая эволюция или пребиотическая эволюция - этап, предшествовавший появлению жизни, в ходе которого органические, пребиотические вещества возникли...
-
Молекулярная и генетическая организация плазмид - Молекулярная и генетическая организация плазмид
Генетическая организация разных плазмид отличается большим разнообразием, так как среди плазмид, на основе их функциональной специфичности, различают...
-
Молекулы ДНК являются линейными макромолекулами, представляющими собой длинные двойные цепи (тяжи) полимеров, составленных из мономеров, получивших...
-
Вирусы как независимые генетические системы Какое место занимают вирусы в биологическом мире? Каково их происхождение и кто их ближайшие родственники?...
-
Обмен белков в организме человека - Строение, функции и значение белков
Важный критерий пищевой ценности белков - доступность аминокислот. Аминокислоты большинства животных белков полностью высвобождаются в процессе...
-
Механизмы апоптоза - Радиационный апоптоз и некроз клеток облученного организма
Развитие и функционирование многоклеточных организмов подразумевает равновесие между синтезом и распадом молекул, их окислением и восстановлением,...
-
Биологические катализаторы - Питательные вещества
В основе всех жизненных процессов лежат тысячи химических реакций. Они идут в организме без применения высокой температуры и давления, т. е. в мягких...
-
В цитозоле клеток 20 различных аминокислот присоединяются б-карбоксильной группой к 3'-гидроксильному акцепторному концу соответствующих тРНК с...
-
Введение - Биосинтез белков. Ген и его роль в синтезе белков
Способность клеток поддерживать высокую упорядоченность своей организации в хаотичной Вселенной зависит от генетической информации, которая реализуется,...
-
Механизм, благодаря которому генетическая информация ДНК "транскрибируется" в матричную РНК, а затем транслируется в белок, выяснился через несколько лет...
-
Генетический скрининг взрослых - Геном человека
В настоящее время нет общенациональных программ генетического скрининга взрослого населения, но некоторые достижения заслуживают упоминания. Лучшим...
-
Расшифровка генетической информации - ДНК
Полимерные цепи белков состоят из мономерных звеньев - аминокислот и последовательность расположения их в белковой молекуле строго специфична. В связи с...
-
Основные стадии в патогенезе СПИДа - Характеристика иммунной системы
1) инкубационный период или первичная латентная стадия (серонегативная) 2) стадия выраженной вирусной репродукции и первичного иммунного ответа...
-
Введение, Белки - Анализ пищевых веществ, необходимых для организма человека
Организм человека состоит из белков (19,6 %), жиров (14,7 %), углеводов (1 %), минеральных веществ (4,9 %), воды (58,8 %), Он постоянно расходует эти...
-
Организменная среда - Основные среды жизни и их характеристики
Организм может также служить средой обитания - для паразитов и симбионтов (симбиоз - совместное, взаимовыгодное сожительство организмов). Например,...
-
Предпосылки к естественной классификации - Эволюция состава организмов
Человечество вообще любит систематизировать полученные знания. Вернее, это диктуется необходимостью, поскольку лишь классификация тех или иных фактов и...
-
Аденозинтрифосфорная кислота (АТФ) состоит из органического основания аденина (I), углевода рибозы (II) и трех остатков фосфорной кислоты (III)....
-
Этапы биосинтеза белка, Транскрипция - Биосинтез белков. Ген и его роль в синтезе белков
Транскрипция Мост между геном (кодонами) и белком обеспечивается РНК. Точнее, информация, закодированная в последовательности азотистых оснований ДНК,...
-
Классификация (подробнее о некоторых из простейших), Жгутиковые - Характеристика простейших
Жгутиковые Жгутиковые -- жизненная форма протистов. Используют жгутики для локомоции или создания токов воды, приносящих пищу. Среди жгутиконосцев много...
-
Ядро осуществляет две группы общих функций: одну, связанную собственно с хранением генетической информации, другую - с ее реализацией, с обеспечением...
-
Элонгация - Молекулярный механизм репликации ДНК
Репликация ДНК осуществляется ДНК-зависимыми ДНК-полимеразами. Данный фермент обладает некоторыми свойствами: 1. Фермент не может начинать синтез. Он не...
-
Транспорт питательных веществ в бактериальную клетку - Физиология микроорганизмов
Пассивный - облегченная диффузия, в следствии разности концентрации питательных веществ, без затрата энергии. Отвечает за транспорт цитоплазматическая...
-
Антибиотики - вещества, избирательно угнетающие жизнедеятельность микроорганизмов, т. е. АБ активны только против микробов при сохранении...
-
Происхождение вирусов и происхождение клетки - Строгие постулаты Коха
Проблема происхождения вирусов - это, по существу проблема независимости генетических элементов в репродуктивном и эволюционном отношении. Основные...
-
РЕСТРИКТАЦИОННЫЕ ЭНДОНУКЛЕАЗЫ. - Генная инженерия
Различные штаммы E-coli, Арбер обнаружил, что ДНК этого фага при переходе через бактерию разрезается и теряет свою инфекционность. Оказалось, что ни...
-
Интерферон - Строгие постулаты Коха
Рассматривая здесь интерферон только как белок, синтезируемый клеткой в ответ на вирусную инфекцию и придающий устойчивость к инфекции другим клеткам,...
-
Вирусы животных - Строгие постулаты Коха
Адсорбция и проникновение в клетку Первые этапы вирусной инфекции, независимо от того, о каком вирусек идет речь, традиционно принято называть...
-
Недостатки раздельного питания - Раздельное питание. Преимущества и недостатки
У принципа раздельного питания есть не только сторонники, но и ярые противники, которые считают, что раздельное питание создает стрессовую ситуацию для...
-
Функция мозжечка заключается в контроле над всеми видами движений. Он "программирует" координацию многочисленных отдельных движений, составляющих один...
-
Белки Белки - это полимеры, состоящие из мономеров - аминокислот. В состав белков входит до 20 различных аминокислот. Соединения из нескольких...
-
В каждом организме (животном, растительном или микробной клетке) все время происходят сложные процессы превращения веществ. Велика роль в этих процессах...
-
Строение гена человека - Геном человека
В каждой диплоидной клетке человека 46 хромосом, содержащих около 6пг ДНК и 3,2 х 109 пар нуклеотидов, длина всех молекул ДНК около 2м. А если учесть,...
-
Классификация белков - Питательные вещества
Белки подразделяются на две большие группы: простые белки, или протеины, и сложные белки, или протеиды. При гидролизе протеинов в кислом водном растворе...
Биоструктуры (БС), состоящие из двух идентичных субъединиц и одной биодобавки (БД), и их характеристики - Анализ этапов эволюции биоструктур до структур, способных объяснить большинство загадок зарождения генетических кодов. Часть 1