Водные растворы электролитов, Растворы электролитов. Степень электрической диссоциации. Слабые электролиты. Константа диссоциации - Систематика химических элементов
Растворы электролитов. Степень электрической диссоциации. Слабые электролиты. Константа диссоциации
Растворы электролитов. Степень электрической диссоциации
Система является раствором электролита, если имеет место электролитическая диссоциация с образованием ионов.
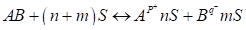
;
Или упрощенно
;
.
Примерами растворов электролитов могут служить растворы солей, неорганических кислот, щелочей.
Растворы электролитов проводят электрический ток и являются проводниками второго рода.
Степень диссоциации электролитов
Под Степенью диссоциации электролита Понимается отношение числа диссоциированных на ионы молекул П к общему числу молекул растворенного электролита N. т. е.
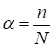
. (47)
В зависимости от степени диссоциации различаются слабые и сильные электролиты. Сильные электролиты при больших концентрациях диссоциированы более чем на 1/2. Степень диссоциации слабых электролитов очень мала по сравнению с 1. Сильные электролиты - это большинство нейтральных солей, сильные кислоты (НСl, НСl04, Н2SO4), сильные основания (NaOH, КОН). Слабые электролиты - это большинство органических кислот, неорганические слабые кислоты и слабые основания, некоторые нейтральные соли CdCl2, Fе(СН3СОО)3. Особенно слабыми электролитами являются вода, сероводород, синильная и борная кислоты.
Между сильными и слабыми электролитами существует переходная группа, которую образуют соли тяжелых металлов, а также некоторые сильные органические кислоты: лимонная, щавелевая, муравьиная.
Степень диссоциации зависит от природы электролита и растворителя, а также от концентрации электролита. С уменьшением концентрации степень диссоциации увеличивается, а при сильном разведении раствора А>1, и различия между сильно и слабодиссоциирующими электролитами сглаживаются.
Степень диссоциации зависит и от диэлектрической проницаемости растворителя: чем больше, тем сильнее диссоциирует электролит. В воде он может быть сильным, а в ацетоне и в особенности бензоле - слабым ( воды, ацетона и бензола соответственно равно 80, 21 и 2.3). Эта закономерность, установленная Нернстом и Томсоном в 1893г., объясняется тем, что, согласно закону Кулона, сила притяжения между разноименно заряженными ионами обратно пропорциональна.
Слабые электролиты. Константа диссоциации
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации уксусной кислоты
СН3СООНСН3СОО- + Н+
Константа равновесия КС будет равна
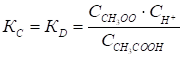
. (48)
Константу равновесия для процесса диссоциации называют Константой диссоциации kD. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества. С увеличением температуры КD обычно уменьшается.
В соответствии с принципом Ле Шателье температурная зависимость kD указывает на то, что процесс диссоциации является экзотермическим, т. е. энергия гидратации ионов выше энергии внутримолекулярных связей.
Константа диссоциации указывает на прочность молекул слабых электролитов в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Похожие статьи
-
СЛАБЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
При растворении в воде слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и продуктами их диссоциации -...
-
Гомогенные равновесия в растворах электролитов Константа ионизации (диссоциации) слабого основания на примере аммиака (запись NH3*H2O предпочтительнее,...
-
Слабые (L<<1, L<<100%) нек. мин. к-ты HNO2, H3PO4, HJ NH3, все ост. органич. основания (Me(OH)2), больш-во органич. кислот НСООН, СН3СООН,...
-
Факторы, влияющие на степень диссоциации - Растворы
Степень электролитической диссоциации зависит от природы растворенного электролита и природы растворителя, концентрации раствора, температуры, наличия...
-
Механизмы электролитической диссоциации, Степень электролитической диссоциации - Растворы
Явление электролитической диссоциации объясняется тем, что взаимодействие полярных молекул растворителя с молекулами растворенного вещества с ковалентной...
-
РАСТВОРЫ ЭЛЕКТРОЛИТОВ, Электролитическая диссоциация - Растворы
Электролитическая диссоциация Теорию электролитической диссоциации предложил шведский ученый Сванте Аррениус в 1887 году для объяснения ряда свойств...
-
Термодинамика растворения. Растворение газов в жидкостях. Закон Генри. Давление пара растворов. Закон Рауля Молекулярным (истинным) раствором называется...
-
Закон разбавления Оствальда - Растворы
В растворах слабых электролитов процесс диссоциации протекает обратимо и устанавливается равновесие, которое можно охарактеризовать константой равновесия...
-
ГИДРОЛИЗ СОЛЕЙ - Характеристика основных видов растворов
Гидролизом называется обменная реакция между веществом и водой. При гидролизе обычно происходит изменение реакции среды. Если гидролиз не сопровождается...
-
Основы теории растворов сильных электролитов - Растворы
Зная величину изотонического коэффициента, полученного экспериментально методами эбуллиоскопии и криоскопии, можно вычислить значение степени диссоциации...
-
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
В водных растворах сильные электролиты полностью диссоциированы, поэтому даже при малых концентрациях растворов энергия электростатического...
-
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - Характеристика основных видов растворов
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Растворы электролитов. Диссоциация кислот, солей и оснований - Основы химии
Электролиты - вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический...
-
Кипение и замерзание растворов - Систематика химических элементов
Следствием снижения давления насыщенного пара растворителя над раствором является повышение температуры кипения по сравнению с чистым растворителем и...
-
Гидролизом соли Называется взаимодействие ионов соли с молекулами воды с образованием слабых электролитов . При этом нарушается равновесие диссоциации...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
Гидролиз солей в водном растворе - Реакция обмена между растворами электролитов
Цель работы. Исследовать характер гидролиза солей. Приборы и реактивы . Штатив с пробирками, растворы карбоната натрия, сульфата меди, хлорида аммония...
-
Прогноз направления реакций и его экспериментальная проверка В тетради должны быть заранее выписаны необходимые константы (см. Приложение), проведены...
-
1.1. Освоить методику определения тепловых эффектов процессов. 1.2. Определить тепловой эффект при нейтрализации кислоты щелочью. 1.3. Вычислить тепловой...
-
Диссоциация воды. Водородный показатель. Гидролиз солей - Основы химии
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды...
-
Влияние разбавления раствора - Химическая кинетика, равновесия, термодинамика
Это, как и в предыдущем параграфе, изменение концентрации, но не одного вещества, а одновременно всех растворенных веществ. Допустим, что объем раствора...
-
Равновесие в растворах труднорастворимых электролитов. Произведение растворимости - Растворы
Абсолютно нерастворимых веществ природе не существует. Даже труднорастворимые вещества в некоторой степени растворяются. Рассмотрим процесс диссоциации...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Гомогенный и гетерогенный катализ - Систематика химических элементов
Вещества, увеличивающие скорость химической реакции, называются Катализаторами. Явление возрастания скорости реакции под действием таких веществ,...
-
Фазовое равновесие. Правило фаз. Диаграмма состояния однокомпонентной системы Гетерогенные равновесия, связанные с переходом веществ из одной фазы в...
-
Принцип Ле Шателье - Систематика химических элементов
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций и минимальному значению энергии Гиббса (G0Т=0), является наиболее...
-
Второе начало термодинамики. Энтропия Объединенное уравнение первого и второго начал термодинамики Рис. 12 Из выражения первого начала термодинамики U =...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
В этой части практикума опыты качественные, без расчетов. Влияние температуры Предлагается запаянный двухколенный стеклянный сосуд, заполненный оксидом...
-
В технике в большинстве случаев инженер имеет дело с дисперсными системами, которые состоят из дисперсной фазы и дисперсионной среды. Дисперсная фаза -...
-
Задачи и упражнения по химическому равновесию - Химическая кинетика, равновесия, термодинамика
При решении расчетных задач используйте цифровые данные из Приложения. Примеры решения подобных задач можно найти в задачнике Глинки [3, 4]. 1. От чего...
-
ВИДЫ РАСТВОРОВ. РАСТВОРИМОСТЬ. ПРОЦЕСС РАСТВОРЕНИЯ - Характеристика основных видов растворов
Растворы - гомогенные системы, состоящие из двух или более компонентов (растворителя, растворенного вещества и продуктов их взаимодействия), состав...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
Водные растворы электролитов, Растворы электролитов. Степень электрической диссоциации. Слабые электролиты. Константа диссоциации - Систематика химических элементов