Энтропия. Второе начало термодинамики, Второе начало термодинамики. Энтропия - Систематика химических элементов
Второе начало термодинамики. Энтропия
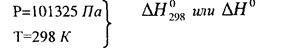
Объединенное уравнение первого и второго начал термодинамики
Рис. 12
Из выражения первого начала термодинамики
U = Q - А
Следует, что изменению внутренней энергии U может соответствовать множество процессов с передачей различных количеств теплоты и работы, лишь бы их алгебраическая сумма оставалась равной величине U.
Однако некоторые процессы, для которых соблюдается первое начало термодинамики, неосуществимы на практике. Со стороны первого начала термодинамики нет никаких препятствий к тому, чтобы при теплообмене двух тел тепло переходило от менее нагретого к более нагретому телу самопроизвольно. Однако из опыта известно, что такие процессы не реализуются.
Запрещая вечный двигатель 1-го рода, первое начало термодинамики не исключает возможности создания такой машины непрерывного действия, которая бы была способна превращать в полезную работу всю подводимую к ней теплоту (так называемый вечный двигатель 2-го рода). В то же время экспериментально установлено, что если работа может быть полностью превращена в теплоту, то только часть теплоты может быть обращена в работу. (Здесь речь не идет о термодинамическом цикле, для которого выполняется принцип эквивалентности теплоты и работы).
Принципом, устанавливающим, какие именно процессы возможны, а какие нет, является Второе начало термодинамики.
1. Формулировка Р. Клаузиуса (1850).
Невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым.
2. Формулировка У. Томсона (1851).
Невозможно теплоту какого-либо тела превратить в работу, не производя никакого другого действия, кроме охлаждения этого тела.
3. Для любого реального процесса невозможно найти способ возвращения системы в ее первоначальное состояние, т. е. любой реальный процесс в термодинамике считается необратимым.
Для количественной оценки степени необратимости реальных процессов Р. Клаузиусом в 1865г. было введено представление о новом термодинамическом параметре, получившем название Энтропии (от Греч. поворот или превращение).
Энтропия - величина, бесконечно малое приращение которой при изотермическом сообщении системе элементарного количества теплоты определяется как
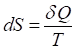
. (22)
Энтропия является функцией состояния, т. е. ее изменение не зависит от пути процесса, а определяется только начальным и конечным состояниями системы:
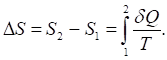
(23)
Энтропия обладает свойством аддитивности, т. е. изменение энтропии всей системы в целом складывается из изменения энтропии отдельных ее частей: изменение энтропии в сложном процессе представляется как сумма изменений энтропии на отдельных ее стадиях.
Второе начало термодинамики представляет собой закон сохранения и возрастания энтропии. Для изолированных систем (дQ=0) второе начало термодинамики имеет вид:
DS 0; ДS 0. ...(24)
Похожие статьи
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Второе начало термодинамики. Энтропия Из предыдущих глав мы знаем много обратимых процессов, но есть и необратимые, например: - переход тепла от горячего...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
Энтропия. Движущее начало химических процессов - Химическая термодинамика. Термохимия. Решение задач
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: "Почему одни химические реакции...
-
Второе начало термодинамики - Физическая химия
Самопроизвольные и несамопроизвольные процессы. Термодинамически обратимые и необратимые процессы. Работа и теплота обратимого процесса. Формулировка...
-
Основы химической термодинамики. Первое начало термодинамики Термодинамические системы и термодинамические параметры. Функции состояния. Парциальные...
-
Основные понятия химической термодинамики - Химическая термодинамика. Термохимия. Решение задач
Прежде чем приступить к изучению предмета химической термодинамики, необходимо ввести ряд терминов и понятий, используемых в этом разделе. Изучаемые...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Первое начало термодинамики. Энтальпия - Химическая кинетика, равновесия, термодинамика
Это закон сохранения энергии. Подводимая к системе теплота Q расходуется на изменение ее внутренней энергии и на совершение работы А: Q = U + А Здесь U =...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Общие сведения Термодинамика - наука о превращениях энергии в различных процессах, как физических, так и химических, и о направлении процессов, о...
-
1. Какие вопросы решает химическая термодинамика? 2. Что называется термодинамической системой? Как классифицируются системы? Приведите примеры различных...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика
А) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S Одновременно действуют обе тенденции...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
Роберт Бойль, Михаил Васильевич Ломоносов - Становление понятий о химическом элементе
Бойль жил в эпоху великих общественных и духовных преобразований. Однако несмотря на сильные религиозные тенденции, Бойль научными работами расчистил...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Смещение равновесия Смещение равновесия - это изменение состояния равновесия (изменение равновесного соотношения количеств исходных веществ и продуктов)...
-
Роберт Боиль - Становление понятия о химическом элементе
Боиль жил в эпоху великих общественных и духовных преобразований. Однако несмотря на сильные религиозные тенденции, Бойль научными работами расчистил...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Фактически это следствие первого начала термодинамики, но сформулирован раньше, чем первое начало. Тепловой эффект изобарного (или изохорного) процесса...
-
ТЕРМОХИМИЯ - Химическая термодинамика. Термохимия. Решение задач
Уравнения химических реакций, учитывающие тепловые эффекты, называются термохимическими уравнениями. Например: 2Н2(г.)+О2(г.) = 2Н2О(г.); ДН = - 476 кДж....
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Если атом находится в основном (т. е. в невозбужденном) состоянии, то его электроны занимают самые низкие по энергиям орбитали. Однако в многоэлектронном...
-
Иоганн Вольфганг Деберейнер - Становление понятия о химическом элементе
Деберейнер изучал химические явления с точки зрения материалистических позиций, исходя из положений атомистической теории. Методологической основой своих...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
В этой части практикума опыты качественные, без расчетов. Влияние температуры Предлагается запаянный двухколенный стеклянный сосуд, заполненный оксидом...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
Энтропия. Второе начало термодинамики, Второе начало термодинамики. Энтропия - Систематика химических элементов