Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры, давления (для газовых реакций), от облучения и наличия катализаторов.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется элементарный акт химического превращения.
Различают Моно -, би - и тримолекулярные реакции.
Рассмотрим реакцию, протекающей по уравнению
AA + bВ продукты. (32)
Чтобы осуществилось данное взаимодействие, молекулы веществ А и В должны столкнуться, при этом их суммарная энергия должна превышать среднюю энергию всех молекул на величину энергии активации. Доля таких молекул будет пропорциональна вероятности их столкновения. А эта вероятность, как вероятность сложного события, пропорциональна произведению вероятностей двух событий Л и В, т. е. что молекулы А и В одновременно окажутся в данной точке реакционного пространства Р(АВ) = Р(А)Р(В).
С другой стороны, вероятности Р(А) и Р(В) пропорциональны числу молекул А и В, т. е. пропорциональны их концентрации. Следовательно, вероятность одновременного присутствия молекул А и В в одной и той же точке будет пропорциональна произведению их концентраций.
Таким образом, скорость химической реакции пропорциональна произведению концентраций реагирующих веществ - Закон действующих масс.
Для реакции вида (32) этот закон примет следующий вид:
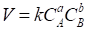
, (33)
Где СА и СВ - концентрации реагирующих веществ А и В соответственно; А и B - Их стехиометрические коэффициенты; К -Константа скорости реакции, численно равная скорости химической реакции, когда концентрации реагирующих веществ равны одному моль на литр, либо их произведение равно единице. К уже не зависит от концентрации реагирующих веществ, но зависит от температуры.
Уравнение (33) называется Кинетическим уравнением реакции. Показатели А и B называются порядками реакции по веществам А И В соответственно. Их сумма (a + b) называется Общим или Суммарным порядком реакции.
Правило Вант-Гоффа
При увеличении температуры на каждые 10 градусов скорость реакции возрастает в 2 - 4 раза:
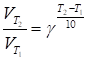
, (34)
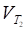
Где, - скорости реакции при температурах T1 и Т2 Соответственно; называется Температурным коэффициентом скорости реакции, который показывает во сколько раз возрастает скорость реакции с увеличением температуры на 10 градусов.
С ростом температуры число активных молекул возрастает, следовательно и увеличивается скорость реакции.
Похожие статьи
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Если атом находится в основном (т. е. в невозбужденном) состоянии, то его электроны занимают самые низкие по энергиям орбитали. Однако в многоэлектронном...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Периодический закон химических элементов: свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической...
-
Еще три следствия из закона Гесса - Химическая кинетика, равновесия, термодинамика
2. Тепловой эффект процесса равен разности между суммами теплот сгорания исходных веществ и продуктов с учетом коэффициентов в уравнении реакции. (при...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
Второе начало термодинамики. Энтропия Объединенное уравнение первого и второго начал термодинамики Рис. 12 Из выражения первого начала термодинамики U =...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Влияние разбавления раствора - Химическая кинетика, равновесия, термодинамика
Это, как и в предыдущем параграфе, изменение концентрации, но не одного вещества, а одновременно всех растворенных веществ. Допустим, что объем раствора...
-
Основы химической термодинамики. Первое начало термодинамики Термодинамические системы и термодинамические параметры. Функции состояния. Парциальные...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Исходные данные для расчета реакторов - Проектирование химического реактора идеального смешения
При выборе конструкции и определении размеров реактора необходимо принимать во внимание различные факторы и, прежде всего, располагать данными о скорости...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Законы стехиометрии - Введение в химию
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же...
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов