Взаимодействие между молекулами, Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия - Систематика химических элементов
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия
Молекула - Химически устойчивое и электрически нейтральное образование. Однако химическая устойчивость отдельной молекулы относительна и проявляется на расстояниях, значительно превышающих размеры самой молекулы.
Уже на расстоянии порядка 1нм между молекулами возникают силы притяжения (ван-дер-ваальсовы силы). При этом их электронные облака не перекрываются, химическая связь не образуется. На расстояниях значительно меньших, чем 1нм возможны перекрывания электронных облаков с образованием новых молекул. Возникающие при этом связи могут иметь различную прочность. Относительно малую прочность имеют водородные связи; более высокую прочность имеют химические связи между молекулами, образованными по донорно-акцепторному механизму.
Слабое взаимодействие между нейтральными молекулами на расстояниях, значительно превосходящих их размеры, было впервые экспериментально обнаружено голландским ученым Ван-дер-Ваальсом. Этим силам приписывают электростатическую природу и обычно выделяют три их составляющие: ориентационную, индукционную и дисперсионную.
Ориентированная (диполь-дипольная) составляющая Представляет собой электростатическое взаимодействие соответствующим образом ориентированных диполей, т. е. полярных молекул. Энергия ориентационного взаимодействия возрастает с увеличением электрического момента диполя молекулы и уменьшается с ростом температуры, т. к. тепловое движение молекул нарушает ориентацию диполей и соответственно снижает энергию их взаимодействия.
Эта составляющая сил Ван-дер-Ваальса проявляется только в системе, состоящей из полярных молекул.
Индукционная составляющая проявляется в системах, состоящих из полярных и неполярных молекул. Под действием электрического поля полярной молекулы в неполярной молекуле происходит наведение (индукция) электрического поля, т. е. неполярная молекула поляризуется под действием электрического поля полярной молекулы. Энергия индукционного взаимодействия будет возрастать с ростом электрического момента диполя полярной молекулы, но не будет зависеть от температуры, поскольку наведение диполя в неполярной молекуле определяется суммарным электрическим полем полярных молекул, окружающих данную, т. е. наведение диполя в неполярной молекуле происходит при любой пространственной ориентации молекул.
Межмолекулярное взаимодействие не исчерпывается ориентационной и индукционной составляющими. Известно большое количество таких веществ, как благородные (Не, Ne, Ar и т. д.) или простые (О2, Н2, N2 и т. д.) газы, молекулы которых одноатомны или неполярны соответственно, но которые могут быть получены в конденсированном состоянии.
Возникновение взаимодействия между подобными молекулами было впервые объяснено немецким ученым Ф. Лондоном (модель Лондона). Он показал, что электростатическое отталкивание между электронами двух каких-либо атомов или молекул снижается, если движение электронов в них происходит таким образом, что электроны все время оказываются максимально удаленными друг от друга. При таком согласованном движении электронов каждый из атомов представляет собой "мгновенный" диполь, положительный полюс которого расположен в ядре атома, а отрицательный - в точке нахождения электрона. При таком согласованном движении электронов "мгновенные" диполи ориентируются разноименно заряженными концами, в результате чего происходит их электростатическое притяжение.
Модель Лондона позволила определить среднюю статистическую величину всех подобных взаимодействий, получившую название Дисперсионной составляющей сил Ваи-дер-Baaльca, которая действует между любыми атомами или молекулами независимо от их строения.
Энергия дисперсионной составляющей будет возрастать с увеличением эффективного радиуса взаимодействующих атомов или молекул, поскольку при этом растет величина поляризуемости атомов или молекул.
Все составляющие вандерваальсовых сил обратно пропорциональны расстоянию в шестой степени между взаимодействующими молекулами. На малых расстояниях между молекулами, когда электростатическое отталкивание ядер и электронов превалирует над электростатическим притяжением, проявляется действие сил отталкивания. На существование сил отталкивания указывает малая сжимаемость жидкостей и твердых тел. Лондон установил, что силы отталкивания обратно пропорциональны расстоянию между молекулами в двенадцатой степени.
Таким образом, полная энергия межмолекулярного взаимодействия может быть представлена в виде алгебраической суммы двух слагаемых
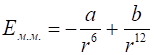
, (6)
Где а и b - константы, характеризующие энергию притяжения и отталкивания соответственно.
Вандерваальсовому взаимодействию свойственна невысокая энергия, соизмеримая с энергией теплового движения молекул, т. е. она примерно на порядок ниже, чем энергия химической связи. Эти силы отличаются от ковалентных сил отсутствием направленности и насыщаемости, и проявляются они на значительных расстояниях.
Похожие статьи
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
ВВЕДЕНИЕ, СТРОЕНИЕ МОЛЕКУЛ И СВОЙСТВА ВОДЫ - Химические свойства и строение воды
Вода - ценнейший природный ресурс. Вода играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Дипольный момент молекулы и связи
Представим себе, что можно найти "центры тяжести" отрицательных и положительных частей молекулы. Тогда условно все вещества можно разбить на две группы....
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Следует отметить, что не существует особых сил, вызывающих адсорбцию. Адсорбция молекул на поверхности твердого тела происходит за счет сил притяжения со...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Если атом находится в основном (т. е. в невозбужденном) состоянии, то его электроны занимают самые низкие по энергиям орбитали. Однако в многоэлектронном...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
Химическая коррозия - Защита от коррозии
Механизм химической коррозии сводится к реактивной диффузии атомов или ионов металла сквозь постепенно утолщающуюся пленку продуктов коррозии (например,...
-
Молекулы, радикалы и ионы - Введение в химию
Молекула - наименьшая частица вещества, определяющая его свойства, способная к самостоятельному существованию. Состоит из одинаковых или разных атомов....
-
Тепловые эффекты при растворении. Механизмы растворения веществ в воде - Растворы
Растворение веществ сопровождается различными тепловыми эффектами в зависимости от природы вещества. При растворении в воде, например, гидроксида калия...
-
Несамостоятельный газовый разряд., Самостоятельный газовый разряд - Электрический ток в газах
Процесс прохождения электрического тока через газ называется газовым разрядом. Если электропроводность газа создается внешними ионизаторами, то...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Новый класс металлорганических соединений, имеющий двухслойную структуру, называется "сэндвичевые соединения". Наиболее изученным из них является...
-
Физические свойства Магния. - Химический элемент Магний
Физические свойства магния. Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти...
-
Второе начало термодинамики. Энтропия Из предыдущих глав мы знаем много обратимых процессов, но есть и необратимые, например: - переход тепла от горячего...
-
Взаимодействие с галогенами При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно...
-
Химия экстремальных состояний - Концепции современного естествознания: химическая составляющая
В отличие от каталитической химии, особенностью которой является химическая активизация молекул реагента, т. е. расслабление исходных химических связей...
-
Химическая связь и строение молекул вещества. - Роль химии в повседневной жизни
Атомистические воззрения возникли первоначально на Древнем Востоке, в античных Греции и Риме. Первоначально атомное учение предполагало существование...
-
Исследования, проводимые в последние годы, указывают на перспективность использования систем, для которых характерна фотоинициируемая валентная...
-
Полупроводниковые квантовые точки могут передавать энергию одному или нескольким подходящим акцепторам [ Clapp A., Medintz I. and Mattoussi H. //...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
Н 2О = О 2- + 2Н+. В Щелочной среде атомы кислорода можно взять из гидроксид-ионов, при этом образуются молекулы воды: 2ОНЇ = О 2- + Н 2О. Пример 1....
-
Во внешнем слое атомов кремния содержится 4 электрона - столько, сколько не хватает до завершения этого слоя. Углерод и кремний относятся к неметаллам....
-
Правила определения степени окисления элемента - Окислительно-восстановительные процессы
Степень окисления - это условный заряд, который приписывается атому При допущении, что все связи в веществе являются Ионными. Известно, что чисто ионной...
-
Результаты исследований А. Н. Фрумкина и Б. В. Дерягина показали, что характер изменения удельной поверхностной энергии е прослоя воды, находящегося...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
В этой работе описаны общая характеристика пероксидов щелочных металлов, их химические и физические свойства, а также их получение. Особое внимание...
-
Химические свойства - Свойства азота
Азот находиться в верхнем правом углу периодической системы, в котором сосредоточены неметаллы с наибольшими сродствами к электронам. Поэтому он должен...
-
Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью...
-
Способ решения основной проблемы химии - проблемы происхождения свойств веществ - стал выражаться посредством схемы: СОСТАВ > СВОЙСТВА Этот способ...
-
Свойства веществ при низких температурах - Свойства веществ при низких температурах
Работы в области жидкого гелия представляют интерес в основном потому, что проводятся вблизи абсолютного нуля, т. е. при очень низких температурах. В то...
-
Арены, Толуол - формула, строение - Арены. Толуол
Арены или ароматические углеводороды - это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым...
-
Введение Нильс Бор принадлежит к числу самых известных исследователей современности. Среди значительных ученых, работавших в области точного...
Взаимодействие между молекулами, Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия - Систематика химических элементов