Ионное произведение. Водородный показатель. Произведение растворимости - Систематика химических элементов
Ионное произведение. Водородный показатель
Электропроводность воды объясняется тем, что вода в очень малой степени диссоциирует, образуя ионы водорода и гидроксид-ионы:
Этот процесс равновесен и, как любой равновесный процесс, его можно охарактеризовать константой равновесия, которая является Константой диссоциации:
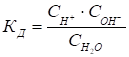
. (49)
При комнатной температуре на ионы распадается лишь одна из 108 молекул воды.
Концентрацию молекул воды можно рассчитать, разделив массу 1л воды на массу 1 моля:
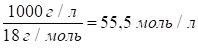
.
В разбавленных растворах концентрация воды изменяется очень мало и ее можно считать постоянной, тогда
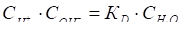
.
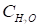
Так как - константа, то ее вносят в КД и обозначают KW
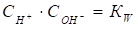
. (50)
Эта величина называется Ионным произведением воды и представляет собой постоянную величину при данной температуре.
В чистой воде при комнатной температуре концентрации ионов водорода и гидроксид-ионов равны между собой и равны 10-7Мoль/л. Следовательно,
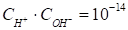
. (51)
Константа равновесия Kw зависит от температуры и не зависит от концентраций катионов H+ и анионов ОН-.
Если в воду добавить кислоту, то концентрация катионов водорода увеличится, равновесие сместится влево, а концентрация гидроксид-ионов уменьшится так, что ионное произведение воды останется неизменным.
Таким образом, в водных растворах при постоянной температуре концентрации катионов водорода и гидроксид-анионов связаны между собой. При расчетах для водных растворов электролитов используют не концентрации, а активности:
Водородный показатель
Для характеристики кислотности (щелочности) среды введен специальный параметр - водородный показатель или рН. Водородным показателем или РН называют взятый с обратным знаком десятичный логарифм активности водородных ионов в растворе:
РН =Lg[.Н+ ]. (52)
Водородный показатель определяет характер реакции раствора. Например, при 295К она нейтральна и рН=7 (Н+ = 10-7 моль/л). При рН<7 (Н+>10-7 моль/л) реакция раствора кислая, при рН>7(Н <10-7 моль/л) - щелочная. С изменением температуры меняется КW.
Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Для оснований подобная зависимость носит обратный характер.
Произведение растворимости
Большинство веществ малорастворимо в воде, поэтому очень часто имеют дело с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Это равновесие носит динамический характер, вследствие чего скорость процесса растворения должна совпадать со скоростью его кристаллизации.
Равновесие в насыщенном растворе электролита AMВN можно представить так:
АMBNMAN+ + nBM-. (53)
Прямой процесс - это растворение осадка, а обратный процесс - это кристаллизация осадка из насыщенного раствора.
Процессы растворения и кристаллизации, которые происходят в этой системе, происходят на поверхности осадка, т. е. система гетерогенна.
Данный гетерогенный процесс можно охарактеризовать следующей константой равновесия:
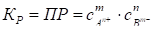
. (54)
Константа равновесия данного процесса представляет собой произведение активностей катионов водорода и гидроксид-анионов.
Произведение активностей ионов малорастворимого электролита, содержащегося в его насыщенном растворе при данной температуре, есть величина постоянная, и называется Произведением растворимости.
Произведение растворимости зависит от природы растворенного вещества и растворителя, а также от температуры и не зависит от активности ионов малорастворимого электролита в растворе.
Произведение растворимости для наиболее важных электролитов рассчитано и содержится в таблицах. Зная произведение растворимости, можно вычислить, выпадает ли в данных условиях вещество в осадок. Условием образования осадка малорастворимого электролита является превышение произведения активностей ионов этого электролита в растворе над табличной величиной произведения растворимости.
Если активность или концентрация одного из ионов малорастворимого электролита увеличится, то равновесие сместится, и, соответственно, активность или концентрация другого иона уменьшится.
Похожие статьи
-
Растворы электролитов. Степень электрической диссоциации. Слабые электролиты. Константа диссоциации Растворы электролитов. Степень электрической...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
Термодинамика растворения. Растворение газов в жидкостях. Закон Генри. Давление пара растворов. Закон Рауля Молекулярным (истинным) раствором называется...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Равновесие в растворах труднорастворимых электролитов. Произведение растворимости - Растворы
Абсолютно нерастворимых веществ природе не существует. Даже труднорастворимые вещества в некоторой степени растворяются. Рассмотрим процесс диссоциации...
-
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ - Характеристика основных видов растворов
В насыщенном растворе малорастворимого сильного электролита устанав-ливается равновесие между твердой фазой (осадком) и ионами электролита: ВaSO4 (в...
-
Фазовое равновесие. Правило фаз. Диаграмма состояния однокомпонентной системы Гетерогенные равновесия, связанные с переходом веществ из одной фазы в...
-
Принцип Ле Шателье - Систематика химических элементов
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций и минимальному значению энергии Гиббса (G0Т=0), является наиболее...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
Кипение и замерзание растворов - Систематика химических элементов
Следствием снижения давления насыщенного пара растворителя над раствором является повышение температуры кипения по сравнению с чистым растворителем и...
-
Задачи и упражнения по химическому равновесию - Химическая кинетика, равновесия, термодинамика
При решении расчетных задач используйте цифровые данные из Приложения. Примеры решения подобных задач можно найти в задачнике Глинки [3, 4]. 1. От чего...
-
Растворимость солей, кислот и оснований в воде, Ионное произведение воды - Ионные реакции
Таблица. Таблица растворимости солей, кислот и оснований в воде Катион Анион H+ NH4+ K+ Na+ Ag+ Ba2+ Ca2+ Mg2+ Zn2+ Cu2+ Hg2+ Pb2+ Fe2+ Fe3+ Al3+ OH- P P...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН) - Характеристика основных видов растворов
Вода - очень слабый электролит, поэтому в незначительной степени диссоциирует на ионы: H2O H+ + OH-. Константа диссоциации воды равна: Kд. = [H+][OH-] /...
-
Второе начало термодинамики. Энтропия Объединенное уравнение первого и второго начал термодинамики Рис. 12 Из выражения первого начала термодинамики U =...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Гомогенный и гетерогенный катализ - Систематика химических элементов
Вещества, увеличивающие скорость химической реакции, называются Катализаторами. Явление возрастания скорости реакции под действием таких веществ,...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
Введение, Общая характеристика химического элемента, Физические свойства - Биогенные элементы. Сера
Семра -- элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16....
-
ДИССОЦИАЦИЯ ВОДЫ. ГИДРОЛИЗ СОЛЕЙ, Ионное произведение воды - Растворы
Ионное произведение воды Вода является очень слабым электролитом, но обладает некоторой измеримой электропроводностью. Процесс электролитической...
-
Соединение Магния., Неорганические соединения магния. - Химический элемент Магний
Для аналитической химии магния имеют значение его труднорастворимые и особенно внутрикомплексные (бесцветные, окрашенные или флуорисцирующие) соединения....
-
Физические свойства Магния. - Химический элемент Магний
Физические свойства магния. Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Твердый, хрупкий, блестяще-черный полуметалл. Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Получение магния. - Химический элемент Магний
Преобладающий промышленный способ получения магния - электролиз расплава смеси MgCl2 расплава в безводных MgCl2, KCl, NaCl. Для получения расплава...
-
Диссоциация воды. Водородный показатель. Гидролиз солей - Основы химии
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
СЛАБЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
При растворении в воде слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и продуктами их диссоциации -...
Ионное произведение. Водородный показатель. Произведение растворимости - Систематика химических элементов