Механизмы электролитической диссоциации, Степень электролитической диссоциации - Растворы
Явление электролитической диссоциации объясняется тем, что взаимодействие полярных молекул растворителя с молекулами растворенного вещества с ковалентной полярной связью, например, хлоридом водорода, приводит к ослаблению связи между атомами, образующими молекулы вещества, и их распаду на ионы (см. рис.6).
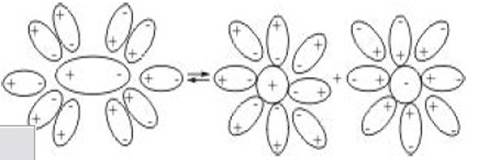
Рис.6 Схема диссоциации полярной молекулы в растворе на ионы.
Ионная кристаллическая решетка разрушается полярными молекулами растворителя за счет электростатического взаимодействия с ионами, из которых построены твердые соли. Растворение ионного кристалла всегда сопровождается электролитической диссоциацией.
Процесс диссоциации некоторого электролита КА можно записать так:
К+А - + х Н2О К+(Н2О)К + А - (Н2О)А.
Процесс электролитической диссоциации количественно можно охарактеризовать следующими величинами:
- - степенью электролитической диссоциации ; - изотоническим коэффициентом i; - константой диссоциации КД.
Степень электролитической диссоциации
Степень электролитической диссоциации - это отношение числа молей вещества, распавшихся на ионы, к общему числу молей растворенного вещества в растворе.
Б = Nдисс/Noбщ, (3.1)
Где б - степень электролитической диссоциации,
NОбщ - число растворенных молекул,
NДисс - число молекул, распавшихся на ионы.
Степень диссоциации может измеряться в долях единицы или в процентах.
По степени диссоциации электролиты делят на сильные, средние и слабые.
Если 30%, то вещество относится к Сильным электролитам, содержит много подвижных ионов и обладает высокой электропроводностью. К сильным электролитам относятся практически все соли; некоторые кислоты: соляная, разбавленная серная, азотная кислота любой концентрации, хлорная, бромистоводородная, иодистоводородная; щелочи (гидроксиды щелочных и щелочно-земельных металлов): NaOH, KOH, Ca(OH)2, Ba(OH)2.
Для Слабых электролитов: 30%.
Фосфорная, сернистая и щавелевая кислоты имеют ? 30%, их можно считать электролитами средней силы.
Для Очень Слабых электролитов: 2 %.
К ним относятся:
- - многие минеральные кислоты: H2CO3, HCN, H2S; - все органические кислоты; - гидроксид аммония NH4OH и гидроксиды всех металлов, кроме щелочных и щелочно-земельных.
Похожие статьи
-
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - Характеристика основных видов растворов
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и...
-
РАСТВОРЫ ЭЛЕКТРОЛИТОВ, Электролитическая диссоциация - Растворы
Электролитическая диссоциация Теорию электролитической диссоциации предложил шведский ученый Сванте Аррениус в 1887 году для объяснения ряда свойств...
-
Слабые (L<<1, L<<100%) нек. мин. к-ты HNO2, H3PO4, HJ NH3, все ост. органич. основания (Me(OH)2), больш-во органич. кислот НСООН, СН3СООН,...
-
Тепловые эффекты при растворении. Механизмы растворения веществ в воде - Растворы
Растворение веществ сопровождается различными тепловыми эффектами в зависимости от природы вещества. При растворении в воде, например, гидроксида калия...
-
Растворы электролитов. Диссоциация кислот, солей и оснований - Основы химии
Электролиты - вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический...
-
ГИДРОЛИЗ СОЛЕЙ - Характеристика основных видов растворов
Гидролизом называется обменная реакция между веществом и водой. При гидролизе обычно происходит изменение реакции среды. Если гидролиз не сопровождается...
-
Теорія електролітичної дисоціації - Теория электролитической диссоциации
Більшість хімічних реакцій, які використовуються у якісному аналізі, протікають у водних розчинах. Якщо речовина розчиняється у воді чи іншому...
-
Гидролиз - р-ция обменного взаимод-я ионов связи, с ионами, входящими в состав Н2О (Н+ и ОН-). Г-з протекает в том случае, если хотя бы один из ионов...
-
СЛАБЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
При растворении в воде слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и продуктами их диссоциации -...
-
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
В водных растворах сильные электролиты полностью диссоциированы, поэтому даже при малых концентрациях растворов энергия электростатического...
-
Диссоциация воды. Водородный показатель. Гидролиз солей - Основы химии
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды...
-
В аналітичній хімії більшість хімічних реакцій проводять у розчинах. Для вираження вмісту аналізованої речовини у розчинах використовують поняття...
-
Важнейшей характеристикой раствора является его состав. Содержание растворенного вещества в растворе может быть выражено безразмерными единицами (долями...
-
РАСТВОРЫ. РАСТВОРИМОСТЬ, Общая характеристика и классификация растворов - Растворы
Общая характеристика и классификация растворов Растворы имеют большое значение для живых организмов (питательные вещества усваиваются в виде растворов;...
-
Целью данной курсовой работы является проведение синтеза ацетата натрия (CH3COONa). Задачами курсовой работы являются: изучение методики неорганического...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ - Характеристика основных видов растворов
В насыщенном растворе малорастворимого сильного электролита устанав-ливается равновесие между твердой фазой (осадком) и ионами электролита: ВaSO4 (в...
-
В технике в большинстве случаев инженер имеет дело с дисперсными системами, которые состоят из дисперсной фазы и дисперсионной среды. Дисперсная фаза -...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Существует три основных типа окислительно-восстановительных реакций: 1. Если окислитель и восстановитель находятся в молекулах различных веществ, то...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Реакции ионного обмена - это реакции между ионами, образовавшимися в результате диссоциации электролитов. Правила составления ионных уравнений реакций 1....
-
Окислители и восстановители Все химические реакции можно разделить на два типа: - Реакции, идущие без изменения степени окисления атомов, входящих в...
-
Соединения мышьяка со степенью окисления -3 Мышьяковистый водород (арсин) AsH 3 . Бесцветный, очень ядовитый газ с чесночным запахом. tПл=-113ОС [1],...
-
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ - Растворы
Коллигативными свойствами называют физико-химические свойства растворов, которые обусловлены Природой растворителя и числом частиц растворенного вещества...
-
Способы выражения концентрации растворов - Растворы
Концентрация раствора отражает количественные соотношения между растворителем и растворенным веществом. Массовая доля (щ) показывает число единиц массы...
-
Растворимость веществ - Растворы
Растворение - самопроизвольный (так как идет с увеличением энтропии в системе) обратимый процесс. Однако растворение возможно только до определенного...
-
Степень с натуральным показателем. Одночлен
Класс: 7 Тип урока: урок обобщения, систематизации знаний. Цели урока: - образовательные: 1. Обобщить и структурировать знания учащихся поданной теме. 2....
-
ВИДЫ РАСТВОРОВ. РАСТВОРИМОСТЬ. ПРОЦЕСС РАСТВОРЕНИЯ - Характеристика основных видов растворов
Растворы - гомогенные системы, состоящие из двух или более компонентов (растворителя, растворенного вещества и продуктов их взаимодействия), состав...
-
Осмотическое давление раствора - Характеристика основных видов растворов
В 1748 году было обнаружено явление перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный, которое назвали...
-
Способы получения насыщенных растворов - Синтез ацетата натрия ("Горячий лед")
Простейший способ приготовления насыщенных растворов - длительное настаивание растворителя с избытком растворяемого вещества, лучше всего при...
-
Определение галоида по методу Кариуса. Навеску вещества при нагревании окисляют дымящей азотной кислотой в присутствии нитрата серебра. При этом галоид...
-
Скорость разложения "мокрым" способом определяется концентрацией реагирующих веществ и температурой. Скорость разложения зависит от величины пробы,...
-
Органические кислоты применяются при разложении минерального сырья лишь в единичных случаях, главным образом в фазовом анализе. Наиболее часто для...
-
Понятие кристаллизации Кристаллизамция -- процесс фазового перехода вещества из жидкого состояния в твердое кристаллическое с образованием кристаллов....
-
Задача количественного химического анализа состоит в определении содержания тех или иных элементов в анализируемом материале; при этом главное требование...
-
1) рассеяние света 2) флотация-всплывание каллоидных частиц на поверхность 3) сидиментация - выпадение в осадок коллоидных частиц 4)коагуляция-уменьшение...
-
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме...
-
Механизм реакции, Растворители - Окисление по Байеру-Виллигеру
В 1948 г. Криге предположил, что реакция Байера-Виллигера протекает по ионному механизму. Первая стадия этого процесса, по-видимому, заключается в...
Механизмы электролитической диссоциации, Степень электролитической диссоциации - Растворы