Направленность ковалентной связи. Гибридизация атомных орбиталей. Пространственная конфигурация молекул. Полярные и неполярные молекулы - Систематика химических элементов
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи:
-связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра атомов (рис.1.):
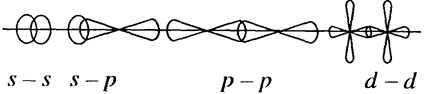
Рис. 1
связь возникает при перекрывании атомных орбиталей в плоскости, перпендикулярной оси, соединяющей ядра атомов (риc. 2):

Рис. 2
Таким образом, s-электроны участвуют лишь в образовании - связи; р - и d-электроны - в образовании - и - связей.
При наложении - связи на - связь образуются кратные связи -Двойные и Тройные.
Число связей между атомами называется Кратностью или Порядком связи.
С увеличением кратности связи длина связи уменьшается, а прочность ее возрастает.
Гибридизация (смешение) атомных орбиталей возникает тогда, когда в образовании химической связи участвуют электроны разных подуровней, поскольку они отличаются и энергией связи, и характером (прочностью и направленностью) образуемых связей.
В результате гибридизации электронных облаков разного типа происходит образование гибридных орбиталей, число которых определяется числом смешиваемых электронных облаков (рис. 3).
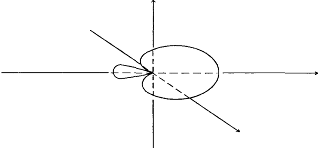
Рис. 3
Перекрывание в случае гибридных орбиталей будет больше, чем в случае чистых орбиталей, поэтому при образовании химической связи будет выделяться больше энергии, а образовавшаяся связь будет прочнее.
При смешении одной s-орбитали и одной p-орбитали образуются две гибридные орбитали, и такой тип гибридизации называется Sp - гибридизацией. Угол между гибридными орбиталями составляет 1800 (рис. 4).
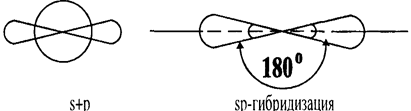
Рис. 4
При смешении одной s - и двух p-орбиталей образуются три гибридные орбитали (sp2-гu6puдuзация); угол между ними равен 120° (рис. 5).
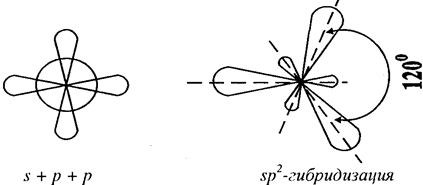
Рис. 5
Взаимодействие одной S и трех P - орбиталей сопровождается Sp3-гu6puдuзацией, при которой угол между гибридными орбиталями ранен 1090 28' (рис. 6)
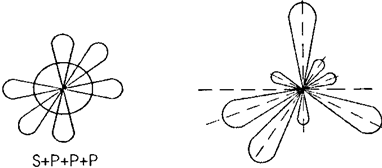
Рис. 6
Направленность химических связей определяет пространственную конфигурацию молекул. Если в состав молекулы входят два атома и перекрывание их атомных орбиталей происходит вдоль линии, соединяющей ядра атомов, то форма такой молекулы является Линейной, а связи в молекуле расположены под углом 180 . Такую же форму имеет молекула в случае Sp-гибридизации орбиталей (рис 7).
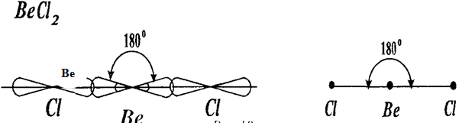
Рис. 7
В случае Sp2-гибридизации молекула (ВСl3) имеет форму Правильного треугольника, в котором угол между связями составляет 120° (рис. 8).
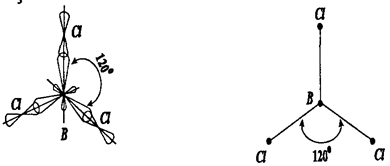
Рис. 8
В случае Sp3 - гибридизации форма молекулы (ССl4) является Тетраэдрической; угол между связями равен 1090 28' (рис. 9).
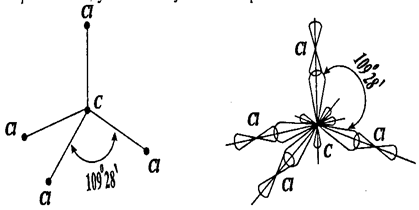
Рис. 9
Полярные и неполярные молекулы
В зависимости от характера распределения электронной плотности между атомами в молекуле различают полярные и неполярные молекулы.
В неполярных молекулах центры тяжести положительного и отрицательного - зарядов совпадают.
Полярные молекулы представляют собой диполи, для оценки полярности которых используют электрический момент диполя молекулы:
М = -, (5)
Где ? - длина диполя молекулы; - Заряд диполя молекулы.
Для двухатомной молекулы электрический момент диполя связи совпадает с электрическим моментом диполя молекулы.
Электрический момент диполя многоатомной молекулы является векторной величиной и представляет собой геометрическую сумму электрических моментов диполей связей, входящих в молекулу.
Похожие статьи
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Молекулы, радикалы и ионы - Введение в химию
Молекула - наименьшая частица вещества, определяющая его свойства, способная к самостоятельному существованию. Состоит из одинаковых или разных атомов....
-
Химическая связь и строение молекул вещества. - Роль химии в повседневной жизни
Атомистические воззрения возникли первоначально на Древнем Востоке, в античных Греции и Риме. Первоначально атомное учение предполагало существование...
-
Дипольный момент молекулы и связи
Представим себе, что можно найти "центры тяжести" отрицательных и положительных частей молекулы. Тогда условно все вещества можно разбить на две группы....
-
Если атом находится в основном (т. е. в невозбужденном) состоянии, то его электроны занимают самые низкие по энергиям орбитали. Однако в многоэлектронном...
-
Химические свойства. Образование ковалентной связи по донорно-акцепторному механизму - Аммиак
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус - синий; фенолфталеин - малиновый)...
-
Химическая связь и валентность, Валентность - Квантовые концепции в химии
Валентность Валентность - это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической...
-
Атомно-молекулярное учение. Основные понятия химии - Основные понятия неорганической химии
Все вещества сост. из атомов. В химию понятие атома ввел Ломоносов: ат. разные, ат. каждого вида один. М/у собой, но отлич. от атомов др. вида., ат....
-
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ, Атомно-молекулярное учение - Основные понятия и законы химии
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс....
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
Следует отметить, что не существует особых сил, вызывающих адсорбцию. Адсорбция молекул на поверхности твердого тела происходит за счет сил притяжения со...
-
Арены, Толуол - формула, строение - Арены. Толуол
Арены или ароматические углеводороды - это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
ВВЕДЕНИЕ, СТРОЕНИЕ МОЛЕКУЛ И СВОЙСТВА ВОДЫ - Химические свойства и строение воды
Вода - ценнейший природный ресурс. Вода играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Победа атомно-молекулярного учения - Естественнонаучные концепции развития химических знаний
В XIX в. четко определились два основных раздела химии: органическая и неорганическая. В конце столетия в самостоятельную отрасль оформилась физическая...
-
Химические свойства - Свойства азота
Азот находиться в верхнем правом углу периодической системы, в котором сосредоточены неметаллы с наибольшими сродствами к электронам. Поэтому он должен...
-
Водородные соединения, Водородная связь - Свойства водорода
В этой таблице слева легкой тенью выделены клетки элементов, образующих с водородом ионные соединения - гидриды. Эти вещества имеют в своем составе...
-
Второе начало термодинамики. Энтропия Из предыдущих глав мы знаем много обратимых процессов, но есть и необратимые, например: - переход тепла от горячего...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Структурные свойства фуллеренов - История открытия фуллеренов, их свойства
В молекулах фуллеренов атомы углерода расположены в вершинах правильных шести - и пятиугольников, из которых составлена поверхность сферы или эллипсоида....
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
Представления Йенса Якоба Берцелиуса - Становление понятий о химическом элементе
Особенно большое значение имели работы шведского химика Берцелиуса, который дал более точные определения атомных масс. Уже до Берцелиуса Дальтон...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Рассмотрим теперь, какое влияние на свойства веществ оказывает порядок соединения атомов в молекуле. Обратимся сначала к историческим фактам. Изучая...
-
Йенс Якоб Берцелиус - Становление понятия о химическом элементе
Особенно большое значение имели работы шведского химика Берцелиуса, который дал более точные определения атомных масс. Уже до Берцелиуса Дальтон...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
Введение, Общая характеристика химического элемента, Физические свойства - Биогенные элементы. Сера
Семра -- элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16....
-
Химические свойства Магния. - Химический элемент Магний
Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина,...
-
Эйльгард Мичерлих. - Становление понятий о химическом элементе
В своих экспериментальных работах Э. Мичерлих обращал собое внимание на точность измерений, взвешивания и определения плотности веществ. Для более точных...
-
Основы новой теории сформулировал 1861 г. профессор Казанского университета Александр Бутлеров. В химии к тому времени уже значительное распространение...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. - Галлий
Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ножом) металл превратился в...
-
Атом сост. из массивн. "+" заряж. ядра и нах-ся в его поле "-"электронов. В ядрах нах-ся практич. вся масса атома. В состав ядра входят элемент. частицы:...
Направленность ковалентной связи. Гибридизация атомных орбиталей. Пространственная конфигурация молекул. Полярные и неполярные молекулы - Систематика химических элементов