Синтез фталевых кислот, аннелированных гетероциклическими хинонами - Разработка эффективных методов синтеза новых макроциклов порфиринового ряда
В связи с тем, что для синтеза целевых фталоцианинов, аннелированные гетероциклическими хинонами мы выбрали метод темплатного синтеза, то первым шагом явился синтез необходимых прекурсоров - фталевых кислот, аннелированных гетероциклическими хинонами.
Нами разработан метод получения фталевых кислот, аннелированных гетероциклическими хинонами, ацилированием диангидридом пиромеллитовой кислоты гетероциклических соединений с последующей внутримолекулярной циклизацией моногидратом /42, 43/.
Электрофильное замещение при атоме углерода, по крайней мере в случае простых производных пиридина, протекает очень сложно по сравнению с бензолом; так, реакция Фриделя-Крафтса вообще не характерна для пиридина. Такая низкая реакционная способность пиридина может быть связана с двумя факторами:
- 1. Низкая концентрация нейтрального пиридина 2. Очень низкая скорость реакции из-за большой энергии образования дважды положительно заряженного интермедиата.
Заместители оказывают такое же влияние на легкость электрофильной атаки, как и в случае бензола. Сильные электроноакцепторные заместители приводят к еще большей инертности пиридинового цикла, в то время как активирующие заместители, такие, как амино-, гидрокси-, или даже алкильные группы, облегчают электрофильное замещение и делают его возможным даже в протонированном пиридине, т. е. через образование дикатионного интермедиата.
Электрофильное замещение в хинолине обычно включает атаку электрофильной частицей по аддукту гетероциклической молекулы с электрофилом (обычно протоном), что дезактивирует гетероцикл к реакциям с электрофилами. Как и в случае нафталина, предпочтительность атаки электрофилом по б - положению может быть объяснена при рассмотрении возможных интермедиатов; при электрофильной атаке по положениям 5/8 хинолина делокализация положительного заряда возможна без нарушения ароматичности пиридинового цикла. При электрофилом по положениям 6/7 делокализация положительного заряда в образующихся интермедиатах возможна только с нарушением ароматичности пиридинового фрагмента. Таким образом, реакция хинолина с электрофильными реагентами протекают по бензольному кольцу, в то время как реакции с нуклеофильными реагентами - по пиридиновому.
В случае бензотриазола ацилирование и алкилирование идет по иминному атому азота, поэтому мы проводили предварительное ацилирование этого атома уксусным ангидридом.
Серусодержащие гетероциклические соединения легко вступают в реакцию ацилирования по Фриделю-Крафтса. В случае бензотиадиазола наличие донорных свойств серы значительно снижает акцепторные свойства атомов азота, что позволяет проводить данную реакцию.
В случае жидких реагентов, ацилирование проводили с большим ( более 10 моль на 1 моль ангидрида) избытком арена, который использовался в качестве реагента и среды, медленно повышая температуру от 20 єС до кипения реакционной массы.


В реакциях с твердыми аренами в качестве среды использовали гептан, инертный в этих условиях и придающий реакционной массе достаточную подвижность, а арен использовался с небольшим избытком (~ 10 %).
Направление ацилирования возможно предсказать только в случае бензотиадиазола (положения 5 и 6), бензотриазола (положения 5 и 6) и 2,3-дигидроксихиноксалина (положения 6 и 7) с образованием соответственно 5-(бензо-2-тиа-1,3-диазол-5-илкарбонил)бензол-1,2,4-трикарбоновой, 5-[(2-ацетил-2Н-1,2,3-бензотриазол-5-ил)карбонил]бензол-1,2,4-трикарбоновой и 5-[(2,3-дигидроксихиноксалин-6-ил)карбонил]бензол-1,2,4-трикарбоновой кислот.

Для оценки места ацилирования других гетероциклических соединений были проведены квантово-химические расчеты, которые выполнены с полной оптимизацией геометрических параметров с использованием метода DFT с учетом электронной корреляции В3LYP, базис 6-31G* (пакет программ Gaussian 98). Распределение электронной плотности определялось с использованием метода NBO.
Из представленных данных (рис. 3.1) и принимая во внимание литературные данные /44/ можно предположить, что ацилирование преимущественно идет в места с повышенной электронной плотностью (выделены полужирным кружком), с образованием 5-(хинолин-6-илкарбонил)бензол-1,2,4-трикарбоновой, 5-[(5-метилпиридин-3-ил)карбонил]бензол-1,2,4-трикарбоновой, 5-[(8-метоксихинолин-7-ил)карбонил]бензол-1,2,4-трикарбоновой, 5-{[5-(ацетиламино)пиридин-3-ил]карбонил}бензол-1,2,4-трикарбоновой и 5-[(4-амино-бензо-2-тиа-1-азол-5-ил)карбонил]бензол-1,2,4-трикарбоновой кислот соответственно.

Хинолин |
В-пиколин |
|
8-метоксихинолин |   
3-ациламинопиридин |
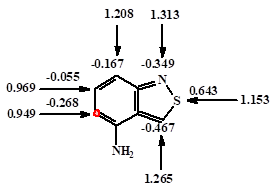
4-аминобензотиазол |
Рис.3.1. Р-электронные плотности (обозначены стрелками) и заряды на атомах
Полученные гетерилтримеллитовые кислоты выделяли обработкой реакционной массы горячим 10 %-ным раствором соды, отделением выпавшего осадка гидроксида алюминия и подкислением фильтратов до рН 3-4.
Перевод полученных гетерилтримеллитовых кислот в соответствующие фталевые кислоты, аннелированные гетероциклическими хинонами, осуществляли в присутствии моногидрата.


Идентификацию полученных фталевых кислот, аннелированных гетероциклическими хинонами (1-8) проводили с привлечением данных элементного анализа, по температурам плавления (таблица 2.1), ИК - и электронной спектроскопии.
![ик-спектр 7,12-диоксо-7,12-дегидронафто[2,3-f]хинолин-9,10-дикарбоновой кислоты](/images/image041-13.jpg)
Рис.3.2 ИК-спектр 7,12-диоксо-7,12-дегидронафто[2,3-f]хинолин-9,10-дикарбоновой кислоты
Характерной особенностью ИК спектров полученных кислот является наличие интенсивного поглощения в области 1700-1710 см-1, соответствующего карбоксигруппам, корме того присутствуют полосы при 1600-1670 см-1, соответствующие связям С=N-C и в области 1100-1150 см-1, характерные для валентных колебаний связи C-N.
Таким образом, на первом этапе работы были разработаны методы синтеза и получены ранее не известные соединения: 4-амино-5,10-диокси-5,10-дигидро-2H-нафто[2,3-f]бензотиазол-7,8-дикарбоновая, 2-ацетил-5,10-диокси-5,10-дигидро-2H-антра[2,3-d][1,2,3]триазол-7,8-дикарбоновая, 3-метил-5,10-диокси-5,10-дигидробензо[g]хинолин-7,8-дикарбоновая, 7,12-диоксо-7,12-дегидронафто[2,3-f]хинолин-9,10-дикарбоновая, 3-(ацетиламино)-5,10-диокси-5,10-дигидробензо[g]хинолин-7,8-дикарбоновая, 5-метокси-7,12-диокси-7,12-дигидронафто[2,3-f]хинолин-9,10-дикарбоновая, 2,3-дигидрокси-6,11-диокси-6,11-дигидронафто[2,3-g]хиноксалин-8,9-дикарбоновая, 5,10-диокси-5,10-дигидро-2H-антра[2,3-d][1,2,3]тиадиазол-7,8-дикарбоновая кислоты.
Похожие статьи
-
Выводы: - Разработка эффективных методов синтеза новых макроциклов порфиринового ряда
1. Ацилированием гетероциклических соединений пиромеллитовым диангидридом с последующей внутримолекулярной циклизацией моногидратом серной кислоты...
-
Общая методика. В трехгорловую колбу емкостью 50 мл, снабженную мешалкой, обратным холодильником и термометром, помещаем 20.0 мл моногидрата и нагреваем...
-
Общая методика. В круглодонной трехгорлой колбе емкостью 100 мл растворяли 11,9 г бензотриазола (2-аминопиридина) в 20 мл толуола. Колбу соединяли с...
-
Порфиразины с аннелированными шестичленными N - гетероциклами - пиридиновыми и пиразиновыми кольцами, среди которых первыми были синтезированы...
-
В виду того, что целью настоящей работы является синтез фталоцианинов, аннелированных гетероциклическими хинонами, получение которых предусматривает...
-
Электронные спектры поглощения соединений (9а, б, 10а, б, 12а, б, 13а, б 15а, б и 16а, б) в концентрированной серной кислоте характеризуются наличием...
-
После идентификации полученные фталевые кислоты, аннелированные гетероциклическими хинонами были использованы для синтеза соответствующих...
-
Определение температуры плавления Температуру плавления определяем с помощью малогабаритного нагревательного стола типа "Boetinus" с наблюдательным...
-
Темплатный синтез М=Cu(x=1) (а), Co(x=2) (б); Общая методика. В кварцевую ампулу помещаем растертую смесь 0.60 ммоль фталевой кислоты, аннелированной...
-
Синтез гетероциклических соединений Синтез 4-амино-1,2-бензотиазола К раствору 5-8 г (31 ммоль) 2,6-диметилтолуола в 15 мл мезителена (температура...
-
С целью определения возможных областей практического использования было проведено изучение жидкокристаллических, колористических свойств полученных...
-
Введение - Разработка эффективных методов синтеза новых макроциклов порфиринового ряда
Химия макроциклов порфиринового ряда давно уже является предметом интесивных исследований вследствие огромного значения и все расширяющегося...
-
Использование систематической номенклатуры ЮПАК очень непрактично для данных типов макроциклов. Четыре гетероцикличесих остатка могут быть показаны как...
-
Сложность строения фталоцианина и его металлокомплексов, существенная зависимость ИК спектров от свойств и от кристаллической структуры приводит к тому,...
-
Химия фталоцианина (Рс) и его металлокомлексов (МРс) началась с его случайных открытий фталоцианина. Линстед с сотрудниками были первыми исследователями...
-
Органические кислоты в различных условиях могут разлагаться с образованием предельного углеводорода по общей схеме O R-C RH + CO2 Кислота OH Углеводород...
-
Методы неорганического синтеза - Синтез ацетата натрия ("Горячий лед")
НЕОРГАНИЧЕСКИЙ СИНТЕЗ, получение неорганических соединений. Как правило, состоит из нескольких последовательных или параллельных процессов -...
-
Обзор литературы - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование - введение нитрогруппы - NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам;...
-
Обработка смесью серной и азотной кислот - метод Дениже. Данный метод часто используют в агрохимических и почвенных лабораториях. В настоящее время...
-
Выбор метода производства (или выделение) готового продукта Современные методы производства азотной кислоты основаны на применении синтетического аммиака...
-
Методы, применяющиеся для синтеза мультиферроиков - Мультиферроики
Для синтеза мультиферроиков используются различные методы синтеза. К ним относятся: спекание, гидротермальный синтез, соосаждение, золь-гель метод,...
-
Реакция с азотной кислотой (реакция нитрования) - Химические свойства насыщенных углеводородов
Концентрированная азотная кислота при нагревании окисляет насыщенные углеводороды, а на холоду - не действует на них. В 1889 г. М. И. Коновалов открыл,...
-
Процессы окисления. - Методы очистки и получения коллоидных растворов
Наряду с серой в реакциях окисления обычно образуются политио-новые кислоты, главным образом пентатионовая кислота H2S5O6 Реакции двойного обмена....
-
Конденсационные методы получения коллоидных систем - Методы очистки и получения коллоидных растворов
Из классификации дисперсных систем по размеру частиц следует, что коллоидные растворы (золи) занимают промежуточное положе-ние между молекулярными и...
-
Методы устранения жесткости - Жесткость воды и способы устранения
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и...
-
Синтез бромэтана проводили в соответствии с методикой, изложенной в источнике [2]. ХОД РАБОТЫ - Приготовление исходных реактивов и собирание прибора Рис....
-
МЕТОД ПЛОСКОПАРАЛЛЕЛЬНОГО ПЕРЕМЕЩЕНИЯ - Основы моделирования геометрических объектов
Изменение взаимного положения проецируемого объекта и плоскостей проекций методом плоскопараллельного перемещения осуществляется путем изменения...
-
Осаждение, Фильтрование - Изучение методов жидких и газообразных и однородных неоднородных систем
Осаждение -- это образование твердого осадка в растворе в ходе химической реакции, например, добавлением соответствующих реагентов. По окончании реакции,...
-
Методы анализа - Свойства флавоноидов
Качественное определение. Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
КОНТАКТНЫЙ МЕТОД ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ. - Получение серной кислоты
Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы. Получение H2SO4 из колчедана....
-
Методы разработки плановых нормативов и норм
Применяемые при планировании нормативные материалы должны в условиях рынка ориентировать каждое предприятие на получение высоких результатов своей...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
Производство лимонной кислоты методом ферментации - Бродильное производство органических кислот
Производство лимонной кислоты методом ферментации при участии грибов также принадлежит к числу давних биотехнологических процессов; оно было налажено в...
-
Качественные методы анализа - Разработка технологической схемы получения анизола и крезола
Рециркуляционных реакционно-ректификационных процессов. При анализе сложных ХТС, характеризующихся большим числом параметров и переменных необходимо...
-
При кипячении с разведенной хлороводородной кислотой происходит процесс гидролиза с образованием бензгидрола: Обнаружение димедрола методом ТСХ....
-
Метод Кьельдаля - обработка серной кислотой так же называют - "мокрое сжигание". Определение количества азота с помощью метода Кьельдаля основано на...
-
Определение галоида по методу Кариуса. Навеску вещества при нагревании окисляют дымящей азотной кислотой в присутствии нитрата серебра. При этом галоид...
-
В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной...
-
Азотный кислота утилизация оксид Методы получения азотной кислоты Первый завод по производству HNO3 из аммиака коксохимического производства был пущен в...
Синтез фталевых кислот, аннелированных гетероциклическими хинонами - Разработка эффективных методов синтеза новых макроциклов порфиринового ряда