Механизм нитрования ароматических углеводородов - Синтез пара-нитродифенила. Теоретические основы нитрования
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая (углеводородная) и кислотная. Благодаря частичной взаимно растворимости реагирующие компоненты распределяются между двумя фазами, и реакция протекает как в этих фазах, так и на поверхности их раздела.
Таблица 2. Показатели процессов нитрования некоторых ароматических углеводородов
|
Исходный углеводород |
Нитросоединение |
Ф. Н.А. |
Расход HNO3 в% от теоретического |
|
Бензол |
Мононитробензол |
70 |
103-105 |
|
Мононитробензол |
Динитробензол |
88 |
110-115 |
|
Толуол |
Мононитротолуол |
70 |
103-105 |
|
Ксилол |
Динитроксилол |
72 |
110-115 |
|
Нафталин |
Мононитронафталин |
61 |
103-105 |
|
Мононитронафталин |
Динитронафталин |
72 |
130-140 |
Легконитруемые углеводороды успевают прореагировать с ионом нитрония на поверхности раздела фаз; в этом случае существенное влияние на скорость реакции оказывает величина этой поверхности, которую можно значительно увеличить интенсивным перемешиванием. Для труднонитруемых углеводородов процесс не успевает пройти на поверхности раздела фаз, и реакция протекает в объеме той фазы, в которую проникают реагенты; для таких реакций поверхность раздела меньше влияет на степень превращения углеводорода и перемешивание способствует лишь насыщению одной фазы другой. Труднонитруемые вещества реагируют в основном в кислотном слое. В органический слой проникает главным образом азотная кислота, которая в отсутствие серной кислоты обладаем меньшей нитрующей способностью.
Стадия отрыва протона от ?- комплекса необратима, что делает необратимой реакцию в целом. Это объясняется сильным электроноакцепторным эффектом нитрогруппы, препятствующим протонированию по связанному с ней атому углерода. Однако если нитрогруппа занимает стерически затрудненное положение, при действии кислот может происходить денитрование, например в 9-нитроантрацене, 3,4,6-триизопропил-2-нитро-N-ацетиланилине или миграция нитрогруппы - например в 3-замещенных 2-нитрофенолах и в 3-замещенных 2-нитроанилинах. Миграция нитрогруппы в 3-R-2-нитроанилинах происходит из геминального узла в ?- комплексе (3), находящемся в равновесии с анилиниевым ионом (4)
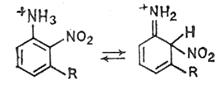
(4) (3)
С использованием спектров ЯМР 15N показано, что превращение 2,3-динитроанилина (5) в смесь 2,5- (6) и 3,4-динитроанилинов (7) (соотношение 2:1) в 98% H2SO4 при 110OC не менее чем на 95% протекает внутримолекулярно.
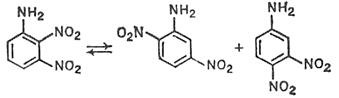
(5) (6) (7)
Константа скорости нитрования по мере увеличения кислотности возрастает, достигая максимума при концентрации H2SO4 90%, а затем снижается. Поскольку содержание ионов NO2+ при концентрации H2SO4 > 90% остается постоянным вследствие полного превращения азотной кислоты, снижение скорости в этом интервале относят к изменению главным образом коэффициента активности субстрата, возможно, в результате образования межмолекулярных водородных связей или протонирования. Для соединений, содержащих электроноакцепторные заместители, процесс протонирования цикла затруднен, так как электронная плотность на атомах углерода мала. При этом можно для увеличения концентрации катиона нитрония использовать концентрированную азотную кислоту и олеум.
Из других сильных кислот кроме серной для нитрования применяют фосфорную, хлорную, трифторуксусную, метан - и трифторметансульфокислоты.
Мощным нитрующим реагентом являются соли нитрония, которые могут быть приготовлены взаимодействием азотной кислоты с HF и кислотами Льюиса (BF3, PF3, SbF5).
Как уже говорилось ранее возможно проведение реакции нитрования и в азотной кислоте, в отсутствие серной кислоты. Преимуществом данного метода является то, что азотная кислота может быть регенерирована. При этом отпадает проблема утилизация разбавленной серной кислоты, азотная кислота возвращается в сферу производства. К существенным недостаткам метода относится необходимость использования коррозионностойкой аппаратуры (эмалированной или из нержавеющей стали), так как разбавленная кислота вызывает ее коррозию. При концентрации азотной кислоты 75% и выше в растворе с помощью спектров комбинационного рассеяния обнаруживается нитроний-катион (в небольших концентрациях, около 2%). Но даже в среде концентрированной серной кислоты не всегда достаточное генерирование ионов нитрония NO2+.
Однако нитрование проводят азотной кислотой с концентрацией от 15% до 63%. В ряде случаев для успеха реакции требуется присутствие азотистой кислоты (соединений азота (III)). Например, нафталин-1,3,5-трисульфокислота, которую в промышленности гладко нитруют в положение 8 действием технической нитрующей смеси, остается неизменной в тех же условиях, если применяется чистая серная кислота и азотная кислота, не содержащая оксидов азота. Для нитрования нафталина азотной кислотой в 56% H2SO4 необходима добавка NaNO2. При нитровании активированных ароматических соединений - N, N-диалкиланилинов, фенолов, анизола, мезитилена и др. азотистая кислота оказывает каталитическое влияние.
В связи с тем, что катион нитрония имеет малый радиус и высокий заряд, он является "жестким" реагентом и атакует ароматический цикл по положению с наибольшей электронной плотностью. При наличии электроноакцепторных групп в фенильном цикле наибольший отрицательный заряд локализован на атоме углерода в м-положении и углероде, связанном с этим заместителем. Существенно меньшая величина электронной плотности имеется в о - и п-положении кольца.
В результате реакции образуется смесь м-, о - и п-нитропроизводных, а также нитробензол.
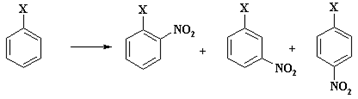
Выход изомерных нитросоединений (без учета образующегося нитробензола), приведен в таблице 3.
Таблица 3. Выходы нитропроизводных
|
Изомеры |
Заместители X, выход в% | ||||
|
Орто- |
18,5 |
28,3 |
19 |
17,1 |
9 |
|
Мета- |
80,5 |
68,4 |
72 |
80,7 |
90 |
|
Пара- |
1 |
3,3 |
9 |
2,2 |
1 |
Высокий выход о-нитропроизводных при нитровании (так называемая "орто-ориентация") может быть объяснен ипсо-атакой катиона нитрония по атому углерода, связанному с электроноакцепторным заместителем, и последующим 1,2-сдвигом с получением "нормального" ?- комплекса.
Способность к ипсо-замещению используют в техническом органическом синтезе. При получении пикриновой кислоты для предотвращения окисления фенола азотной кислотой, ведущего к значительному осмолению реакционной массы, ароматическое ядро вначале дезактивируют с помощью введения электроноакцепторных сульфогрупп и только затем проводят нитрование:
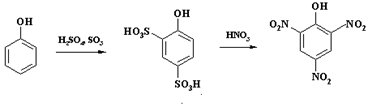
На первой стадии образуется фенол-2,4-дисульфокислота, сульфогруппы в которой далее замещаются нитрогруппами и проходит нитрование в положение 6 цикла.
Синтез о - и п-нитрофенола, а также 2,4-динитрофенола осуществляют с помощью щелочного гидролиза соответствующих хлорбензолов. В последнее время разработан способ получения и пикриновой кислоты с помощью нитрования 2,4-динитрохлорбензола. Нитрование фенола не проводят, так как реакция идет очень энергично, а также в основном в связи с тем, что азотная кислота (особенно разбавленная) обладает высокой окисляющей способностью. Так, даже при нитровании бензола образуется примесь нитрофенолов за счет окисления азотной кислотой.
Подобно сульфогруппе ипсо-замещению подвергаются и другие группировки.
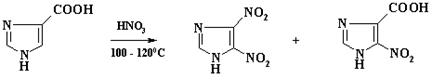
Низкая региоселективность наблюдается при нитровании бензолсульфокислоты. Наряду с м-нитробензолсульфокислотой образуется до 15% о-изомера. Однако трудно объяснить наличие в реакционной массе нитробензола, т. к. концентрация отработанной серной кислоты составляет 93 - 95%, а в этих условиях процесс десульфирования маловероятен.
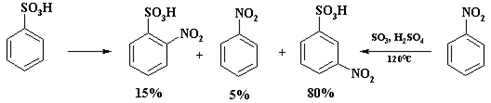
В промышленности м-нитробензолсульфокислоту получают сульфированием нитробензола, при этом образуется только один изомер.
Аномальные результаты реакции нитрования объясняются тем, что происходит "ипсо"-замещение с последующим 1,2-сдвигом:
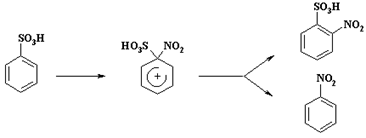
Катион нитрония атакует атом углерода связанный с сульфогруппой. Образующийся "аномальный" - комплекс переходит в ароматическое состояние как за счет отщепления сульфогруппы, так и за счет смещения нитрогруппы к соседнему атому углерода (1,2-сдвиг) и отрыву протона от "нормального" - комплекса.
Для решения проблемы низкой селективности процесса проводят нитрование в среде уксусного ангидрида. При нитровании в уксусном ангидриде образуется ацетилнитрат, который в малой степени дает катион нитрония:
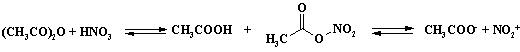
Ацетилнитрат пожаро - и взрывоопасен, применяют этот реагент в тех случаях, когда с помощью других методов не удается достичь нужного результата. В связи с низкой концентрацией электрофильного агента в растворе селективность процесса увеличивается. Пример сравнительной селективности при нитровании пара-хлортолуола (Таблица 4).
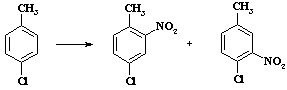
Таблица 4. Региоселективность реакции нитрования
|
Условия нитрования |
Выход 2-нитро-4-хлортолуола (%) |
Выход 3-нитро-4-хлортолуола (%) |
|
HNO3; SO3 |
55 |
45 |
|
H2SO4; HNO3 |
65 |
35 |
|
(CH3CO)2О; HNO3 |
87 |
13 |
Похожие статьи
-
Обзор литературы - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование - введение нитрогруппы - NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам;...
-
Кинетика процесса нитрования - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование ароматических углеводородов смесями азотной и серной кислот протекает по ионному механизму. В. В. Марковников указал, что при взаимодействии...
-
Обсуждение результатов - Синтез пара-нитродифенила. Теоретические основы нитрования
Для нитрования дифенила использовалась смесь азотной и уксусной кислот. Так как при нитровании в смеси азотной и серной кислот образуются...
-
Реакция с азотной кислотой (реакция нитрования) - Химические свойства насыщенных углеводородов
Концентрированная азотная кислота при нагревании окисляет насыщенные углеводороды, а на холоду - не действует на них. В 1889 г. М. И. Коновалов открыл,...
-
Введение - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрования - один из важнейших процессов в химической промышленности. Продукты, получаемые за счет нитрования, являются полуфабрикатами для производства...
-
Экспериментальная часть - Синтез пара-нитродифенила. Теоретические основы нитрования
A. Реагенты и оборудование Для проведения синтеза использовались следующие реагенты: Дифенил C12H10 Молекулярная масса: 154.2 Температура кипения: 256°C...
-
Теоретические основы каталитического пиролиза - Пиролиз углеводородного сырья
Теоретические основы процесса каталитического пиролиза в настоящее время изучены недостаточно. В качестве активных компонентов катализаторов для пиролиза...
-
Выводы, Перелік літератури - Синтез пара-нитродифенила. Теоретические основы нитрования
В результате курсовой работы была проработана литература по нитрованию ароматических углеводородов. Была найдена методика получения 4-нитродифенила, по...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Органические кислоты в различных условиях могут разлагаться с образованием предельного углеводорода по общей схеме O R-C RH + CO2 Кислота OH Углеводород...
-
Данные для расчета: Основная реакция: (1) Побочные реакции: Рабочий объем катализатора - 24 м3. Расход оксида углерода и метанола на побочные продукты с...
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Класс алкилбензолов представлен 37 соединениями в табл.3, где приведены экспериментальные данные, использованные нами при определении значений параметров...
-
Теоретические основы масс-спектрометрии Масс-спектрометрия представляет собой метод исследования веществ, основанный на определении массы (точнее,...
-
Синтез полимеров - Полимеры и материалы на их основе
Полимеры получают методами полимеризации или поликонденсации. Полимеризация (полиприсоединение). Это реакция образования полимеров путем...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
В последнее время органические вещества признаны определяющими весь ход гидрогеохимических процессов и техногенеза окружающей среды в целом. Основную...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Еще в начале 20 века было установлено, что при взаимодействии СО и Н2 в присутствии соответствующих катализаторов можно получить углеводороды. Так, в...
-
Полупроводниковые квантовые точки могут передавать энергию одному или нескольким подходящим акцепторам [ Clapp A., Medintz I. and Mattoussi H. //...
-
Синтезы на основе ацетилена - Анализ и технологическая оценка химического производства
Ацетилен СН=СН -- газ, легко вступающий в самые различные химические реакции с образованием многочисленных соединений, используемых при получении...
-
Гибридные системы на основе квантовых точек (КТ) и органических лигандов могут быть использованы в качестве хемо-, био - и фотосенсоров, а также...
-
При пропускании смеси окиси углерода (СО) и водорода (Н2) над нагретым до 2000С катализатором, содержащим восстановленное железо, образуются смеси...
-
Получение синтезированного газа - Анализ и технологическая оценка химического производства
Химические методы переработки нефти проводят при высоких температурах без катализатора (термический крекинг), при высоких температурах в присутствии...
-
Методы неорганического синтеза - Синтез ацетата натрия ("Горячий лед")
НЕОРГАНИЧЕСКИЙ СИНТЕЗ, получение неорганических соединений. Как правило, состоит из нескольких последовательных или параллельных процессов -...
-
Синтез бромэтана проводили в соответствии с методикой, изложенной в источнике [2]. ХОД РАБОТЫ - Приготовление исходных реактивов и собирание прибора Рис....
-
Использование предшественников при производстве аминокислот позволяет успешно обходить метаболический контроль, осуществляющийся по механизму обратной...
-
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде...
-
Взаимодействие с галогенами - Химические свойства насыщенных углеводородов
В обычных условиях хлор и бром реагируют с насыщенными углеводородами, но лишь очень медленно. Если встряхивать жидкий предельный углеводород с бромной...
-
Заключение - Теоретические основы статистики результатов экономической деятельности
1. С целью выявления тенденций среди компаний Западной Сибири, мы взяли официальные, достоверные данные о величине валовой прибыли 31 компании за 2015...
-
Заключение - Синтез на основе оксидов углерода и водорода
Огромное значение имеет освоенный в 20-е годы процесс получения из синтез-газа метанола - важнейшего продукта химической промышленности. В то же время...
-
Основные технологические показатели процесса - Синтез на основе оксидов углерода и водорода
Конверсию исходного сырья рассчитываем как отношение количества израсходованного сырья (СО+Н2) - (Gн - Gк), где Gк - количество непрореагировавшего...
-
Экономико-математические методы представляют собой совокупность математических методов (математического программирования, теории вероятностей, теории...
Механизм нитрования ароматических углеводородов - Синтез пара-нитродифенила. Теоретические основы нитрования