Теоретические основы каталитического пиролиза - Пиролиз углеводородного сырья
Теоретические основы процесса каталитического пиролиза в настоящее время изучены недостаточно.
В качестве активных компонентов катализаторов для пиролиза в публикациях, предлагаемые отечественными и зарубежными исследователями, предлагаются соединения многих элементов периодической системы, в большинстве случаев оксиды металлов переменной валентности (например: ванадия, индия, марганца, железа, хрома, молибдена и др.), оксиды и алюминаты щелочных и щелочноземельных металлов (большей частью кальция и магния) и редкоземельных элементов, а также кристаллические или аморфные алюмосиликаты [1].
С целью выявления особенности процесса был изучен каталитический пиролиз ряда индивидуальных углеводородов в присутствии катализатора на основе окисла металла переменной валентности [2]. Опыты проводили на лабораторной установке проточного типа в кварцевом реакторе со стационарным слоем катализатора. В качестве каталитической системы был использован ванадиево-кислый калий-мета, нанесенный в количестве 20% масс. на природный алюмосиликат - пемзу. Результаты исследования показывают, что в присутствии катализатора конверсия исходного углеводорода и выход продуктов реакции значительно выше, чем при термическом пиролизе, проведенном в аналогичных условиях. Сопоставление данных по каталитическому и термическому пиролизу при одинаковой конверсии свидетельствует об определенном влиянии катализатора на распределение продуктов реакции. Так, например при каталитическом пиролизе всех изученных углеводородов выход на разложенное сырье водорода, метана, этилена и окислов углерода больше, а пропилена, углеводородов С4 и кокса меньше, чем при том же значении конверсии в условиях термического пиролиза. Однако принципиальных различий в составе продуктов каталитического и термического пиролиза не наблюдается, что дает основание предположить, что каталитический пиролиз представляет собой гомогенный процесс с гетерогенными стадиями и протекает по радикальному механизму, свойственному термическому пиролизу.
Рассмотрим вероятный механизм каталитического пиролиза на примере пропана. Достаточно высокая активность катализатора пиролиза проявляется только при высоких температурах, что свидетельствует о большой роли гомогенного зарождения. Для пропана оно протекает по уравнению:
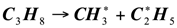
(1.9)
Частично данная реакция может идти на поверхности катализатора. Это подтверждает энергия активации каталитического пиролиза пропана, которая составляет 182,1±5,4кДж/моль [4], в отличие от 239 кДж/кг [5] для термического пиролиза пропана, и свидетельствует о наличии гетерогенной составляющее в стадии зарождения радикалов. Вместе с тем сравнительно высокое значение энергии активации еще раз подтверждает большую роль гомогенного зарождения. Более вероятна на поверхности катализатора энергетически затрудненная реакция инициирования, заключающаяся в отрыве атома водорода от молекулы пропана:
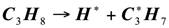
(1.10)
Для развития цепи распада приняли схему, аналогичную термическому пиролизу пропана. Экспериментальные данные [2] показывают, что состав продуктов каталитического пиролиза пропана удовлетворительно отвечает этой схеме. Особенностью каталитического процесса является то, что отдельные реакции указанные в схеме, протекают на поверхности катализатора, что и влечет за собой некоторые различия в распределении продуктов каталитического и термического пиролиза:
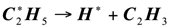
(1.11)
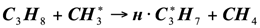
(1.12)
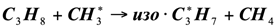
(1.13)
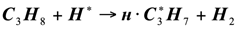
(1.14)
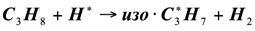
(1.15)
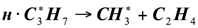
(1.16)
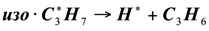
(1.17)
Рекомбинация:
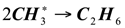
(1.18)
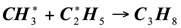
(1.19)
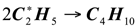
(1.20)
При каталитическом пиролизе как пропана, так и других изученных углеводородов образуется больше водорода [2], возможно донором водорода при каталитическом пиролизе является вода, которая распадается на поверхности катализатора и способствует выделению водорода по следующим реакциям:
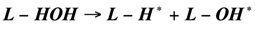
(1.21)
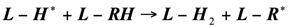
(1.22)
Где - углеводородный радикал поверхностного типа.
Дополнительное количество водорода при каталитическом пиролизе выделяется также за счет того, что катализатор усиливает реакцию газификации кокса водяным паром. Об этом свидетельствует более высокое содержание С в СО, СО2 при каталитическом пиролизе всех исследованных углеводородов [2], тогда как суммы С в СО, СО2 и коксе при каталитическом и термическом пиролизе отличаются не столь значительно.
При каталитическом пиролизе парафиновых углеводородов, пропана и н-бутана, этилена образуется больше, а пропилена меньше, чем при термическом пиролизе [2]. Такая закономерность выполняется как при близкой к нулевой, так и при более высоких степенях превращения. Увеличение количества этилена при каталитическом пиролизе говорит, очевидно, о том, что в присутствии катализатора происходит преимущественное образование н-пропильного и первичного бутильного радикалов по отношению соответственно к изопропильному и вторичному бутильному или протекает изомеризация изопропильного и вторичного бутильного радикалов в первичные. При сравнительно высокой степени превращения различия в выходах этилена и пропилена может объясняться также различной глубиной протекания вторичных реакций превращения олефинов в условиях термического и каталитического процессов.
Таким образом, применение катализаторов пиролиза позволяет существенно увеличить скорость реакции собственно разложения (крекинга) углеводородов без увеличения скорости вторичных реакций типа присоединения, в которых расходуется этилен, другие алкены, алкадиены. Это приводит к увеличению выходов алкенов и позволяет применить более мягкие условия, чем при термическом пиролизе.
Вместе с тем значение вторичных реакций при каталитическом пиролизе возрастает с увеличением удельной поверхности (пористости) катализаторов, так как десорбция и переход в объем радикалов и алкенов с поверхности, расположенной внутри пор, затруднен. При этом повышается выход этилена и других низших олефинов.
Похожие статьи
-
Высокотемпературный пиролиз с газообразным теплоносителем - Пиролиз углеводородного сырья
Процесс высокотемпературного пиролиза в адиабатическом реакторе, осуществляемый в присутствии нагретого до 1600-2000оС теплоносителя, характеризуется...
-
Пиролиз в присутствии гомогенных инициаторов - Пиролиз углеводородного сырья
Широкое применение получили различные добавки и инициаторы способные инициировать процесс пиролиза, а также ингибировать нежелательные процессы. В...
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
Пиролиз в присутствии гетерогенныхкатализаторов - Пиролиз углеводородного сырья
Гетерогенные каталитические системы, которые применимы к высокоэндотермическим реакциям, обеспечивают высокие скорости реакций и, как следствие, снижение...
-
Литературный обзор - Пиролиз углеводородного сырья
Баланс печь пиролиз углеводородный Развитие химической промышленности за последние несколько десятилетий характеризуется увеличением производства...
-
Основные опасности производства - Пиролиз углеводородного сырья
Опасность технологического процесса определяет: 1. Применение в качества сырья и реагентов жидких, газообразных токсичных углеводородов С1 ? С5...
-
Повышение или понижение уровня в емкостях, разделителях и колоннах может привести к нарушению технологического режима, а недопустимое повышение или...
-
К настоящему времени единственным освоенным и широко распространенным в промышленности методом пиролиза является термический пиролиз в трубчатых печах....
-
Введение - Пиролиз углеводородного сырья
В настоящее время нефтехимический потенциал промышленно развитых государств определяется объемами производства низших олефинов. Основным источником их...
-
Технология производства, Обоснование способа и технологии - Пиролиз углеводородного сырья
Обоснование способа и технологии Проект выполнен на основе действующего производства пиролиза углеводородов нефти объекта 2-3-5/III АО "Уфаоргсинтез",...
-
Выбор и обоснование параметров контроля и регулирования - Пиролиз углеводородного сырья
Обязательным условием нормального ведения процесса пиролиза является поддержание постоянного расхода сырья, пара, охлаждающей воды, контроль и...
-
Экологическое обоснование производства - Пиролиз углеводородного сырья
Главной проблемой нефтехимических процессов является уменьшение газовых выбросов в атмосферу и сброса загрязненных сточных вод в водоемах. В процессе...
-
Термоконтактные процессы пиролиза - Пиролиз углеводородного сырья
Разработка процессов пиролиза, основанных на передаче тепла пиролизуемому сырью при его контакте с нагретыми теплоносителями, относилась к 50-60-м годам...
-
Темой данного дипломного проекта является получение низших олефинов пиролизом бутановой фракций. С целью обеспечения безопасности производства в...
-
Мероприятия по охране окружающей природной среды - Пиролиз углеводородного сырья
Газовой лабораторией ЦЗЛ осуществляется систематический контроль за содержанием едкого натра в щелочных стоках объекта. С целью сокращения воздействия...
-
Электробезопасность - Пиролиз углеводородного сырья
Электрооборудование и электроаппаратура, устанавливаемые на установке, по своему исполнению должны соответствовать классу взрывоопасных зон, категориям и...
-
Закалочно-испарительный аппарат (Х-1) представляет собой теплообменник смешения. Поток пирогаза охлаждается водой, которая, испаряясь, забирает часть...
-
Пиролиз углеводородного сырья в расплавленных средах - Пиролиз углеводородного сырья
В качестве расплава употребляют некоторые металлы (свинец, висмут, кадмий, олово и другие) и их сплавы, соли (хлориды, карбонаты и другие) или...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
Макрокинетика процесса - Каталитический риформинг
Характерной особенностью всех модификаций риформинга является то, что одна из его основных стадий - ароматизация - эндотермична, а другая - гидрокрекинг...
-
1. Продуть аппараты и коммуникации перед пуском ингазом до содержания кислорода в отходящем после продувки газе не более 2% об. 2. Перед розжигом...
-
Мероприятия по обеспечению безопасности производства - Пиролиз углеводородного сырья
В соответствии с ГОСТ-12.3.002-88 безопасность производственного процесса обеспечивается выбором режима работы технологического процесса, оборудования,...
-
Сырье - смесь углеводородов, обладает высокой испаряемостью при обычной температуре. Огнеопасен. Вдыхание большого количества паров бензина вызывает...
-
1. Для защиты органов дыхания все работники объекта обеспечиваются индивидуальными фильтрующими противогазами с коробкой марки "БКФ" в соответствии с...
-
Расчет основного оборудования, Расчет для действующего типа змеевика - Пиролиз углеводородного сырья
Расчет для действующего типа змеевика Определение размеров реакционного змеевика печи Камера радиации Количество потоков: n = 2; Размер труб, мм: 140х8;...
-
Узел смешения. Определение температуры сырья на входе в печь Тепловой баланс узла смешения: Qподв = Qс, Где Qподв - подводимое тепло, кДж/ч; Qс - тепло...
-
Выбор средств контроля и регулирования зависит от условий технологического режима. При выборе средств контроля и регулирования руководствуются следующими...
-
Заключение, Список использованных источников - Пиролиз углеводородного сырья
Данная работа посвящена расчету процесса термического пиролиза углеводородного сырья В литературном обзоре приведены теоретические основы процесса и...
-
Исходные данные Суммарная производительность по олефинам (этилен + пропилен), т/час 7,882 Сырье бутан технический Состав сырья, % об. Пропан 15,8 Бутан...
-
При строгом соблюдении порядка подготовки, пуска в работу или остановки объекта (как и отдельных видов оборудования) пропусков продуктов, как правило, не...
-
Технологическая схема производства - Пиролиз углеводородного сырья
В данном разделе излагается описание технологического процесса и технологической схемы отделения пиролиза углеводородов нефти. Сырье с температурой...
-
Обзор литературы - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование - введение нитрогруппы - NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам;...
-
Эксплуатация производства, Нормы технологического режима - Пиролиз углеводородного сырья
Нормы технологического режима Нормы технологического режима приведены в таблице 5.1. Таблица 5.1 - Нормы технологического режима Наименование стадий...
-
Действия персонала во время аварии Во всех случаях аварийного останова немедленно сообщить ведущему инженеру-технологу, диспетчеру ОАО "Уфаоргсинтез" и...
-
Пуск и остановка установки пиролиза - Пиролиз углеводородного сырья
Перед пуском необходимо: 1. Произвести внешний осмотр всего оборудования, запорной и предохранительной арматуры, коммуникаций, приборов КИП с целью...
-
Автоматический контроль и регулирование - Пиролиз углеводородного сырья
Развитие отрасли нефтехимического и органического синтеза в наше время невозможно без применения автоматического контроля. Ежегодно вводятся в действие...
-
Методы и средства защиты работающих от производственных опасностей 1. Во всех производственных помещениях и на рабочих местах в объекте установлены...
-
Прорыв газа, пожар на объекте - Пиролиз углеводородного сырья
1 При прорыве газа необходимо: 1.1 Подать пар на паротушение в секцию печей, вентили на паротушение окрашены в красный цвет. 1.2 Сообщить пожарной...
-
Описание системы контроля регулирования, сигнализации и блокировки - Пиролиз углеводородного сырья
Поз (20). Контроль уровня в отстойнике (О-2). Уровень измеряется буйковым уровнемером сапфир 22ДУ-ВН (20-1), выходной сигнал подается на вторичный...
Теоретические основы каталитического пиролиза - Пиролиз углеводородного сырья