Кинетика процесса нитрования - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование ароматических углеводородов смесями азотной и серной кислот протекает по ионному механизму. В. В. Марковников указал, что при взаимодействии серной и азотной кислот образуется нитросерная кислота:
HNO3 + H2SO4 HOSO2-ONO2 + H2O
В дальнейшем было установлено (Титов, Инголд, Беннет), что нитросерная кислота в водной среде диссоциирует с образованием нитроний-катиона:
H2O
HOSO2-ONO2 NO2+ + HSO4-
Ионы нитрония образуются и в концентрированной (безводной) азотной кислоте, не содержащей серной кислоты:
2HNO3 NO3H+ + NO3-
NO3H2+ NO2+ + H2O
При добавлении воды к азотной кислоте диссоциация HNO3 c образованием нитроний-катиона NO2+ подавляется почти полностью, концентрация этих ионов становится ничтожно малой.
Серная кислота реагирует не только с азотной кислотой, но и с водой, образуя ион гидроксония H3O+ и бисульфатный анион HSO4-:
H2SO4 + H2O H3O+ + HSO4-
Таким образом, процесс взаимодействия азотной и серной кислот можно выразить следующим уравнением:
HNO3 + 2H2SO4 NO2+ + H3O+ + 2HSO4- (1)
Следовательно, главным активирующим действием серной кислоты является превращение азотной кислоты в наиболее сильное нитрующее средство - нитроний-катион NO2+
В безводной азотной кислоте (без серной кислоты) концентрация иона нитрония составляет около 2% вследствие самодегидратации.
2HNO NO2+ + NO3- + H2O (2)
Существование NO2+ доказано с помощью спектров комбинационного рассеяния (наблюдается интенсивная полоса при 1400 см). В растворах HNO3 + H2SO4; HNO3 + HClO4; HNO3 + HBF4 азотная кислота практически полностью ионизована, были выделены в твердом виде соли катиона нитрония NO2+X- (X = ClO4, HSO4, BF4). Добавление воды к концентрированной азотной кислоте приводит к уменьшению содержания иона NO2+, и при наличии более 5% воды его сигнал в спектре КР исчезает. Реакция нитрования по мере добавления воды замедляется, сохраняя первый порядок по субстрату.
В органических растворителях, таких как CCl4, ацетонитрил, нитрометан, сульфолан, образование катиона NO2+ по уравнению (2) является стадией, определяющей скорость нитрования, вследствие чего реакция имеет нулевой порядок по ароматическому субстрату. Добавки веществ, влияющих на концентрацию NO2+, сказываются на скорости нитрования. Так, введение нитратов или воды, подавляя ионизацию, замедляет нитрование.
В среде концентрированной серной кислоты равновесие целиком сдвинуто вправо (1). Исследование спектроскопическими (КР-, ИК-, УФ - спектроскопия), криоскопическим и кондуктометрическим методами привело к заключению, что полное превращение HNO3 в NO2+ сохраняется при снижении концентрации H2SO4 до 90%; при концентрации H2SO4 82-70% присутствуют только неионизированные молекулы HNO3, при разбавлении H2SO4 ниже 70% появляются анионы NO3-, а ниже 15% присутствуют только ионы NO3-. По данным спектров ЯМР 14N, для 0,5 М раствора HNO3 степень превращения в NO2+ в среде 91,2% H2SO4 составляет 92%, в 88,6% - 54%, в 86,2% - 12%, а в 81% содержание NO2+ ниже предела чувствительности метода.
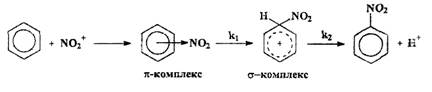
Нитрование ароматических углеводородов нитроний-катионом протекает как ионно-комплексная реакция. Сначала нитроний катион NO2+ присоединяется к ядру ароматического углеводорода, затем от образовавшегося соединения отрывается протон.
Более подробно этот процесс можно расписать через образование ?- и ?- комплекса. Лимитирующей стадией является образование ?- комплекса, т. е. скорость процесса нитрования определяется скоростью присоединения нитроний-катиона к углеродному атому в молекуле ароматического углеводорода, так как протон отщепляется от этого углеродного атома почти мгновенно. Лишь в отдельных случаях нитрования в пространственно затрудненное положение отмечался значительный первичный кинетический изотопный эффект, обусловленный, очевидно, ускорением обратной реакции на стадии образования ?- комплекса из-за стерических препятствий и именно в таких случаях стадия образования ?- комплекса не является лимитирующей. К таким примерам относятся нитрование антрацена в положение 9 солями нитрония (KH/KD=6,1 в ацетонитриле, 2,6 в нитрометане), нитрование 1,3,5-три (трет-бутил)-2-R-бензолов азотной кислотой в серной кислоте (R=F, NO2, CH3, KH/KD=2,3-3,7). Но в большинстве случаев стадия образования ?- комплекса является определяющей для скорости процесса.
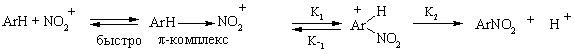
Поэтому уравнение скорости нитрования будет выглядеть так:
WНитр =
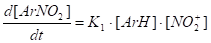
K2 >> K1 и K-1, так как отсутствует кинетический изотопный эффект и связывание протона не ускоряет реакцию. Величиной K-1 пренебрегают.
В концентрированной серной кислоте равновесие практически нацело сдвинуто вправо. Тогда кинетическое уравнение можно представить в следующем виде:

Как видно из уравнения, скорость реакции обратно пропорциональна концентрации воды и сульфат иона и прямо зависит от концентрации азотной кислоты. Это хорошо просматривается в условиях проведения реакции нитрования ряда ароматических соединений, содержащих электронодонорные или электроноакцепторные заместители.
Правила ориентации:
- 1. Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т. е. оказывают ориентирующее действие. 2. Все заместители в бензольном кольце делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Ориентанты 1-го рода (орто-пара-ориентанты) направляют последующее замещение преимущественно в орто - и пара-положения. К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
-R (+I); - OH (+M,-I); - OR (+M,-I); - NH2 (+M,-I); - NR2 (+M,-I)
+M-эффект в этих группах сильнее, чем - I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто - и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства: - F (+M<-I), - Cl (+M<-I), - Br (+M<-I).
Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный - I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце.
Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в мета-положение. К ним относятся электроноакцепторные группы:
-NO2 (-M, - I); - COOH (-M, - I); - CH=O (-M, - I); - SO3H (-I); - NH3+ (-I); - CCl3 (-I).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто - и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше.
Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Нитрующая способность смеси серной и азотной кислот характеризуется фактором нитрующей активности (Ф. Н.А.):
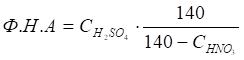
В этой формуле дробь характеризует степень возрастания концентрации серной кислоты после израсходования всей HNO3 и выделения соответствующего количества H2O:
Таблица 1. Условия реакции нитрования некоторых ароматических соединений ArX
|
Х |
Избыток HNO3 (моль) |
Состав нитрующей смеси,% |
Температура, 0С | ||
|
HNO3 |
H2SO4 |
H2O | |||
|
NHCOCH3 |
0 |
31 |
48 |
21 |
0 - 5 |
|
CH3 |
0 |
24 |
59 |
17 |
40 |
|
H |
0 |
20 |
65 |
15 |
40-60 |
|
Cl |
0 |
18 |
71 |
11 |
60-80 |
|
COOC2H5 |
0,1 |
18 |
75 |
7 |
80-95 |
|
NO2 |
0,1 |
18 |
80 |
2 |
90-100 |
|
1-CH3,2,4-ди-NO2 |
0,15 |
18 |
82 |
0 |
100-120 |
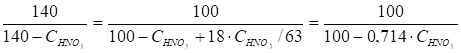
Где 18 и 63 - молекулярные массы воды и азотной кислоты.
Следовательно, Ф. Н.А. численно равен концентрации отработанной H2SO4 при условии полного использования HNO3. При этом Ф. Н.А., тем более высокое, чем ниже реакционная способность этого соединения. Для каждого процесса нитрования имеется предел Ф. Н.А., ниже которого нитрование практически не идет. Когда азотная кислота почти полностью израсходована на нитрование, фактор нитрующей активности приближается к концентрации серной кислоты в отработанной смеси
Расход азотной кислоты на нитрование определяется стехиометрическими соотношениями; это количество несколько увеличивают с учетом побочных процессов окисления, потерь кислоты и др., а так же для интенсификации процесса и более полного превращения ароматического соединения. Необходимый избыток азотной кислоты сверх расчетного определяют для каждого нитруемого углеводорода опытным путем. Естественно, что степень использования азотной кислоты оказывается в таком случае ниже 100%.
Количество вводимой серной кислоты определяется фактором нитрующей активности Ф. Н.А. В таблице 2 приведены показатели промышленных процессов нитрования некоторых ароматических углеводородов.
Похожие статьи
-
Обзор литературы - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование - введение нитрогруппы - NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам;...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
Обсуждение результатов - Синтез пара-нитродифенила. Теоретические основы нитрования
Для нитрования дифенила использовалась смесь азотной и уксусной кислот. Так как при нитровании в смеси азотной и серной кислот образуются...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Экспериментальная часть - Синтез пара-нитродифенила. Теоретические основы нитрования
A. Реагенты и оборудование Для проведения синтеза использовались следующие реагенты: Дифенил C12H10 Молекулярная масса: 154.2 Температура кипения: 256°C...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Введение - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрования - один из важнейших процессов в химической промышленности. Продукты, получаемые за счет нитрования, являются полуфабрикатами для производства...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
Данные для расчета: Основная реакция: (1) Побочные реакции: Рабочий объем катализатора - 24 м3. Расход оксида углерода и метанола на побочные продукты с...
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
Процесс плавления дисперсии - Синтез полиуретанов
Проблемы, связанные с аминным расширением цепи удается избежать в этом процессе. NCO-концевые полиуретановые преполимеры подвергают взаимодействию с...
-
Основные технологические показатели процесса - Синтез на основе оксидов углерода и водорода
Конверсию исходного сырья рассчитываем как отношение количества израсходованного сырья (СО+Н2) - (Gн - Gк), где Gк - количество непрореагировавшего...
-
Экономико-математические методы представляют собой совокупность математических методов (математического программирования, теории вероятностей, теории...
-
Выводы, Перелік літератури - Синтез пара-нитродифенила. Теоретические основы нитрования
В результате курсовой работы была проработана литература по нитрованию ароматических углеводородов. Была найдена методика получения 4-нитродифенила, по...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
-
Теоретические основы каталитического пиролиза - Пиролиз углеводородного сырья
Теоретические основы процесса каталитического пиролиза в настоящее время изучены недостаточно. В качестве активных компонентов катализаторов для пиролиза...
-
Процесс приготовления, Ацетон процесс - Синтез полиуретанов
Самый ранний способ получения водной дисперсии полиуретана был ацетон процесс, который по-прежнему остается технически важным [10]. В последние пару...
-
Синтез полимеров - Полимеры и материалы на их основе
Полимеры получают методами полимеризации или поликонденсации. Полимеризация (полиприсоединение). Это реакция образования полимеров путем...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Реакция с азотной кислотой (реакция нитрования) - Химические свойства насыщенных углеводородов
Концентрированная азотная кислота при нагревании окисляет насыщенные углеводороды, а на холоду - не действует на них. В 1889 г. М. И. Коновалов открыл,...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Теоретические основы масс-спектрометрии Масс-спектрометрия представляет собой метод исследования веществ, основанный на определении массы (точнее,...
-
Технологические свойства метанола Метанол (метиловый спирт) СН3ОН представляет бесцветную легкоподвижную жидкость с температурой кипения 64,65°С,...
-
Одностадийный процесс, Двухстадийный процесс - Синтез полиуретанов
Одностадийный процесс является самым быстрым и самым легкимиз всех техник получения. Функциональный или мультифункциональный жидкий изоцианат и жидкий...
-
Синтезы на основе ацетилена - Анализ и технологическая оценка химического производства
Ацетилен СН=СН -- газ, легко вступающий в самые различные химические реакции с образованием многочисленных соединений, используемых при получении...
-
1. Золотарев А. А. Математическое моделирование и оптимизация распределительных систем. Saarbrucken: LAP Lambert Academic Publishing, 2016. 184 с. 2....
-
Прототипом разработанной автором системы моделей служит "точечная" модель [1], представляющая собой пространственно осредненный вариант уравнений горения...
-
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде...
-
В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной...
-
Синтез бромэтана проводили в соответствии с методикой, изложенной в источнике [2]. ХОД РАБОТЫ - Приготовление исходных реактивов и собирание прибора Рис....
-
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества,...
-
Фотоэлектроколориметрические методы относятся к объективным методам, так как интенсивность окраски растворов оценивают с помощью специальных устройств -...
-
Метанол -- сырье для многих производств органического синтеза. Основное количество его расходуется на получение формальдегида. Он служит промежуточным...
-
Технологии производства метанола - Синтез на основе оксидов углерода и водорода
Способ, основанный на сухой перегонке древесины, до 1913 года оставался единственным освоенным процессом получения метанола, а в 1913 г. был разработан...
-
Понятие календарного планирования В условиях оживления и развития отечественной промышленности существенно возрастает интерес к проблемам организации...
-
Заключение - Синтез на основе оксидов углерода и водорода
Огромное значение имеет освоенный в 20-е годы процесс получения из синтез-газа метанола - важнейшего продукта химической промышленности. В то же время...
-
Еще в начале 20 века было установлено, что при взаимодействии СО и Н2 в присутствии соответствующих катализаторов можно получить углеводороды. Так, в...
Кинетика процесса нитрования - Синтез пара-нитродифенила. Теоретические основы нитрования