Теоретическая часть - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
Кинетика электродных процессов.
Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале, отличном от равновесного. В отличие от обычной гомогенной химической реакции, протекающей во всех точках объема раствора, где есть реагирующие вещества, электрохимическая реакция идет на границе раздела между электродом и раствором, т. е. является реакцией гетерогенной. А следовательно, любой электродный процесс всегда имеет ряд последовательных стадий: сначала реагирующее вещество подходит к электроду, затем происходит собственно электрохимическая стадия, связанная с переносом электронов или ионов через границу раздела фаз (стадия разряда - ионизации), наконец, образовавшиеся продукты реакции должны отойти от поверхности электрода, чтобы освободить место для новой порции реагирующего вещества. Первая и третья стадии имеют одинаковые закономерности и называются стадиями массопереноса.
Стадии массопереноса и разряда - ионизации присутствуют во всех без исключения электродных процессах. Помимо этих стадий при протекании электродных реакций встречаются также и другие. Часто электродные процессы осложняются стадией образования новой фазы. Так при электроосаждении металлов реализуются стадии образования кристаллических зародышей. В ходе электрохимического процесса может происходить перемещение частиц по поверхности электрода (стадия поверхностной диффузии) от центров, на которых идет заряд, до некоторых других, где продукту реакции находиться энергетически более выгодно. Если поверхность электрода несет заряд, одинаковый с зарядом реагирующей частицы, то электрическое поле двойного слоя препятствует адсорбции этой частицы, поэтому необходимо учитывать стадию вхождения реагирующей частицы в двойной электрический слой.
По термодинамическим причинам каждая электрохимическая реакция может протекать только в определенной области потенциалов: катодная реакция - при потенциалах электрода отрицательнее, анодная реакция - при потенциалах положительнее равновесного потенциала данной реакции. Это условие означает только возможность протекания электродной реакции в соответствующей области потенциалов, но ничего не говорит о том, протекает ли реакция на самом деле и какова ее скорость.
Скорость реакции - количество превращаемого в единицу времени реагента - пропорциональна току [1,2]. Значение же тока зависит не от собственных свойств гальванической цепи, а задается извне, и его можно произвольно менять от нуля до предельного для данной системы значения. Поэтому фактическая скорость не является показателем электродной реакции. Однако при прохождении тока возникает поляризация электрода
,
Т. е. сдвиг потенциала от его равновесного значения. Значение поляризации зависит как от природы реакции, так и от плотности тока. Таким образом, количественной характеристикой относительной скорости электрохимической реакции является поляризация при определенной плотности тока (i) или плотность тока при определенной поляризации.
Катодная поляризация, как известно, оказывает сильное влияние на структуру электролитического осадка и равномерность отложения металла. При электрокристаллизации этих металлов вследствие большой катодной поляризации получаются мелкокристаллические осадки.
Катодное выделение металлов, как и выделение водорода, происходит не вполне обратимо и требует некоторой добавочной поляризации. Правда, во многих случаях выделение металла начинается при почти равновесном потенциале, например при электролизе простых солей ртути или висмута.
При электролизе простых солей меди, серебра, цинка, кадмия, свинца наблюдается заметная поляризация, хотя и меньшая, чем при выделении водорода. С повышением температуры поляризация убывает и выше 70 она уже близка к нулю; с повышением плотности тока она возрастает. Особенно сильно это возрастание поляризации для металлов группы железа.
В первый момент электролиза на поверхности катода образуется некоторое количество случайно ориентированных зародышей. Однако если при определенных условиях электролиза кристаллы в некоторых направлениях растут предпочтительнее, чем в других, то те кристаллы, максимальная скорость роста которых направлена перпендикулярно поверхности катода, займут все пространство. В то же время кристаллы, ориентированные иначе, окажутся вытесненными, закрытыми. Таки образом, через некоторое время после начала электролиза возникает текстура.
При электролизе растворов простых солей металлов характер катодных отложений и величина электродной поляризации определяются природой осаждаемого металла [6]. Металлы обычно делят на три группы. К первой относят те, которые выделяются без перенапряжения (Hg) или с очень малым перенапряжением (Ag, Tl, Pb, Cd, Sn). Для этой группы твердых металлов характерна неустойчивость потенциала во времени, губчатый характер роста катодного осадка. Вторую группу металлов образуют Bi, Cu, Zn. Для них характерно некоторое перенапряжение и образование более мелкокристаллических осадков.
Наибольшей величиной перенапряжения обладают металлы третьей группы (Fe, Ni, Co). Эти металлы выделяются на катоде в виде плотных мелкокристаллических осадков.
В процессе электрокристаллизации металлов все факторы, способствующие увеличению поляризации, ведут к росту скорости зарождения центров кристаллизации. Такая связь между поляризацией и скоростью образования зародышей объясняется тем, что энергия активации, необходимая для образования зародыша, значительно больше энергии, затрачиваемой на рост уже имеющих кристаллов. В связи с тем, что при электролизе изменяются число и величина образующихся кристаллов, истинная плотность тока весьма заметно отличается от плотности тока, рассчитанной по геометрической поверхности электрода.
Преобладание процесса возникновения новых зародышей над скоростью роста уже имеющихся кристаллов особенно характерно для комплексных электролитов, а также для растворов простых солей, содержащих ПАВ (поверхностно-активное вещество) [6]. В последнем случае из-за адсорбции чужеродных частиц на растущих гранях линейная скорость роста кристаллов уменьшается, и осадки получаются высокодисперсными. Весьма часто при этом они не имеют даже четко выраженной кристаллической структуры.)
Перенос реагирующих веществ в условиях электрохимической реакции может осуществляться по трем механизмам. Первый (основной) механизм - молекулярная диффузия, т. е. перемещение частиц вещества под действием под действием градиента концентрации. Поскольку концентрационные изменения вблизи поверхности электрода всегда, сопутствуют протеканию электрохимической реакции, молекулярная диффузия наблюдается во всех без исключения электродных процессах. Раздел электрохимической кинетики, в котором рассматриваются стадии массопереноса, называют диффузионной кинетикой.
Второй механизм массопереноса - миграция связан с перемещением частиц под действием электрического поля, который возникает в диффузионном слое при прохождение через него электрического тока.
Третий механизм массопереноса-конвекция, т. е. перенос вещества вместе с потоком движущейся жидкости. Конвекция не может устранить диффузию, так как по мере приближения к электроду скорость движения жидкости относительно его поверхности падает, а градиент концентрации возрастает. Поэтому чем ближе к поверхности, тем большую роль в процессе массопереноса играет диффузионный механизм.
Количественное описание диффузионных процессов проводят на основании установления функциональной зависимости между плотностью тока i (в электрохимической кинетике плотность тока является мерой скорости электродного процесса) и величиной электродного потенциала Е. Установление этой зависимости возможно с использованием трех основных уравнений диффузионной кинетики.
Первое основное уравнение диффузионной кинетики связывает скорость диффузионного процесса с распределением концентрации реагирующего вещества вблизи электродной поверхности.
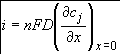
(1.1)
Второе основное уравнение диффузионной кинетики - уравнение Нернста, заменяя активности на соответствующие концентрации получаем:
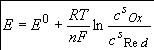
(1.2)
Именно отличие концентраций сs от их объемных значений с0 вызывает сдвиг потенциала электрода от его равновесного значения Ep. Поэтому поляризацию
?E=E-Ep
В условиях лимитирующей стадии массопереноса называют концентрационной поляризацией. Отклонение от равновесия в этих системах локализуется в пределах диффузионного слоя.
Из этих двух уравнений следует, что для нахождения i и Е нужно знать распределение концентрации вблизи электродной поверхности. Это распределение можно получить путем решения уравнения второго закона Фика, которое в случае линейной диффузии имеет вид:
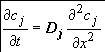
(1.3)
Уравнение (1.3) является третьим основным уравнением диффузионной кинетики.
Согласно уравнению (1.2), изменение потенциала электрода происходит в условиях диффузионной кинетики приводит к изменению приповерхностных концентраций реагентов и продуктов. Таким образом, задавая зависимость Е от t, мы тем самым задаем определенные граничные условия для системы решения уравнения (1.30) (когда отсутствуют миграция и конвекция, а диффузия имеет место вдоль координаты х). Каждый вид зависимости E(t), приводит к своему решению диффузионной задачи, которое определяет форму поляризационной кривой. Если Е=Ер, то выполняется равновесие, и, значения приповерхностных ск s концентраций и их общие концентрации ск0 равны. В этих условиях синусоидальные колебания потенциала с малой амплитудой колебаний (v<<RT/F) вызывают соответствующие колебания ск s, которые распространяются в объем раствора, постепенно затухая по мере удаления от поверхности электрода
Если Е<Eр, то равновесное состояние нарушается. Когда выполняются условия cks = const, ck0 = const, т. е Е= const, это приводит к выражению:
I = zFDk1/2*ck0 /П1/2* *t1/2 (1.4)
Приходим к выводу, что
Дэфф= П1/2*Dk1/2*t1/2
В условиях нестационарной диффузии при Е= const играет роль эффективной толщины диффузионного слоя.
Исследования процессов электрокристаллизации востребованы в промышленности, прежде всего в электрометаллургии и гальванотехнике [8].
Гальванотехника -- отдел прикладной электрохимии, который включает гальваностегию и гальванопластику.
Гальванопластика -- получение сравнительно толстого слоя металлических осадков на поверхности какого-либо предмета. Целью гальванопластики является получение точной металлической копии предмета. При гальванопластике осадки получаются массивными, прочными, легко отделяющимися от покрываемой поверхности. Основное применение в гальванопластике имеет медь; более ограниченное использование железа, никеля, серебра, золота, а также олово, хром и другие металлы и их сочетания. Копируемое изделие, если оно само изготовлено не из электропроводящего материала, покрывают тонким слоем электропроводящего материала, и затем наносят гальваническое покрытие. Этот слой обычно делают легко отделяющимся от поверхности изделия, например, натирают порошок графита, либо токопроводный лак. В гальванопластическом производстве труб и других полых предметов электролитическое осаждение в ряде случаев ведется на сердечники из легкоплавких сплавов, которые потом удаляются путем нагрева выше температуры их плавления.
Гальваностегия -- электролитическое осаждение тонкого слоя металла на поверхности какого-либо металлического предмета для защиты его от коррозии, повышения износоустойчивости, предохранения от цементации, в декоративных целях и т. д. Получаемые покрытия -- осадки -- должны быть плотными, а по структуре -- мелкозернистыми. Чтобы достигнуть мелкозернистого строения осадков, необходимо выбрать соответствующие состав электролита, температурный режим и плотность тока. Выбор способа покрытия зависит от назначения и условий работы изделия. Эти процессы впервые осуществил российский ученый Б. Якоби в 1836 г.
Похожие статьи
-
Методика эксперимента. Простейшая электролитическая ячейка, которая может быть использована для снятия поляризационных кривых, представлена на рис. 2.5...
-
Введение - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
С развитием современной металлообрабатывающей промышленности и непрерывным ростом ассортимента изделий из металлов постоянно расширяется область...
-
Методика эксперимента. Кислотность рабочих растворов определяли с помощью хингидронного электрода. Хингидронный электрод представляет гладкую платиновую...
-
Определение удельной и молярной электропроводности сульфатных растворов Методика эксперимента. В исследованиях использовали растворы: 0,1 M CuSO4; 0,01...
-
Удельная электропроводность раствора увеличивается, а молярная - понижается с увеличением концентрации. При добавление раствору CuSO4 Na2SO4 , удельная...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Кинетика процесса нитрования - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование ароматических углеводородов смесями азотной и серной кислот протекает по ионному механизму. В. В. Марковников указал, что при взаимодействии...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Скорость разложения "мокрым" способом определяется концентрацией реагирующих веществ и температурой. Скорость разложения зависит от величины пробы,...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Теоретические основы каталитического пиролиза - Пиролиз углеводородного сырья
Теоретические основы процесса каталитического пиролиза в настоящее время изучены недостаточно. В качестве активных компонентов катализаторов для пиролиза...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Существует три основных типа окислительно-восстановительных реакций: 1. Если окислитель и восстановитель находятся в молекулах различных веществ, то...
-
Аналитический обзор - Выпаривание раствора хлорида калия
Устройство выпарных аппаратов. Разнообразные конструкции выпарных аппаратов применяемых в промышленности, можно классифицировать по типу поверхности...
-
Обзор литературы - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование - введение нитрогруппы - NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам;...
-
Анализ модели - Кинетические закономерности взрывного свечения азида серебра
Рассмотрим процесс развития реакции при произвольной степени разложения. Нас будет интересовать вид кинетических зависимостей концентрации носителей цепи...
-
Все аминокислоты, из которых состоят белки, являются" L-а-амино - (или имино-) кислотами. Они находят применение как пищевые добавки, приправы, усилители...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Органические кислоты применяются при разложении минерального сырья лишь в единичных случаях, главным образом в фазовом анализе. Наиболее часто для...
-
В сухую колбу Кьельдаля вносят 0,1 г исследуемого продукта, наливают 5 см3 концентрированной серной кислоты. Добавляют небольшое количество катализатора....
-
Приготовление растворов - Расчеты при приготовлении водных растворов
Концентрация растворов Масса раствора состоит из массы вещества и массы воды, т. е. Концентрация раствора Для дезинфекции чаще всего используются...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Адсорбция активированный уголь Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и...
-
Теоретическое обоснование математического моделирования - Математические методы и модели в экономике
Коммерческая деятельность в том или ином виде сводится к решению таких задач: как распорядиться имеющимися ресурсами для достижения наибольшей выгоды или...
-
Диспергированием называют тонкое измельчение твердых мате-риалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате...
-
При работе флотационной машины в пульпе создаются значительные перепады давления. Поэтому, в соответствии с законом Генри, в зонах повышенного давления...
-
Динамическое программирование Динамическое программирование -- один из разделов оптимального программирования, в котором процесс принятия решения и...
-
Процессы окисления. - Методы очистки и получения коллоидных растворов
Наряду с серой в реакциях окисления обычно образуются политио-новые кислоты, главным образом пентатионовая кислота H2S5O6 Реакции двойного обмена....
-
Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные...
-
Горючие системы Подразделяются на однородные и неоднородные. Однородными являются системы, в которых горючее вещество и воздух равномерно перемешаны друг...
-
ГИДРОЛИЗ СОЛЕЙ - Характеристика основных видов растворов
Гидролизом называется обменная реакция между веществом и водой. При гидролизе обычно происходит изменение реакции среды. Если гидролиз не сопровождается...
-
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - Характеристика основных видов растворов
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и...
Теоретическая часть - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов