Хемосенсоры на основе полупроводниковых квантовых точек, Хемосенсоры на основе механизма фотоиндуцированного переноса электрона - Свойства нейтральной формы гибридного соединения
Гибридные системы на основе квантовых точек (КТ) и органических лигандов могут быть использованы в качестве хемо-, био - и фотосенсоров, а также молекулярных логических устройств (МЛУ) в случае наличия двух устойчивых состояний системы, обладающих различными спектрально-люминесцентными свойствами. Для этого в одном состоянии лиганд должен быть инертным, позволяя люминесцировать КТ, а в другом - тушителем люминесценции. Существует два вида механизма тушения люминесценции - фотоиндуцированный перенос электрона (PET) и ферстеровский резонансный перенос энергии (FRET).
Рассмотрим подробнее хемосенсоры, работающие на основе этих механизмов тушения люминесценции.
Хемосенсоры на основе механизма фотоиндуцированного переноса электрона
Полупроводниковые КТ могут быть окислены или восстановлены при относительно небольших потенциалах, которые незначительно зависят от размеров частиц [ Wang, C. J.; Shim, M. and Guyot-Sionnest // P. Science, 2001, 291, 2390., Kucur, E.; Riegler, J., Urban, G. A. and Nann, T. // J. Chem. Phys., 2003, 119, 2333.]. В таблице 2 приведена зависимость окислительных (Eox) и восстановительных (Ered) потенциалов квантовых точек CdS от их диаметров (d) [15].
Таблица 2. Окислительно-восстановительные потенциалы КТ CdS относительно пары ферроцен/ферроцений
|
D, нм |
Ered, В |
Eox, В |
|
3.0 |
-1.29 |
+0.94 |
|
4.3 |
-1.27 |
+0.80 |
|
6.5 |
-1.16 |
+0.79 |
Кроме того, при возбуждении КТ могут обмениваться электронами с дополнительными донорами или акцепторами [ Querner, C.; Reiss, P.; Sadki, S.; Zagorska, M. and Pron, A. // Phys. Chem. Chem. Phys., 2005, 7, 3204.]. Такие процессы эффективно тушат люминесценцию частиц и, следовательно, могут быть использованы для управления их излучением. В частности, возможно создание молекулярных сенсоров для активации или подавления фотоиндуцированного переноса электрона в определенных условиях и, соответственно, "выключения" или "включения" люминесценции системы. В этих условиях супрамолекулярная ассоциация целевого анализируемого вещества приводит к существенному изменению интенсивности люминесценции [ Burda C., Chen X., Narayana R. and El-Sayed M. A. // Chem. Rev., 2005, 105, 1025.- Tomasulo M., Yildiz I., Raymo F. // J. Phys. Chem. B., 2006, 110, 3853.].
Например, мальтоза-связывающий белок (maltose-binding protein, MBP), вырабатываемый бактериями E. Coli, может быть использован для управления люминесценцией связанной с ним квантовой точки по механизму фотоиндуцированного переноса электрона [ Yildiz, I.; Tomasulo, M. and Raymo, F. // Proc. Natl. Acad. Sci. USA., 2006, 103, 11457.]. Для этого при помощи металлотионеина (MT) получается гибридный белок MBP-MT, который затем связывается с рутениевым донором (рис. 3).
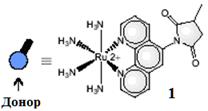
Рис. 3 Рутениевый донор
Полученный модифицированный белок закрепляется на квантовой точки CdS после обмена с частью инертного лиганда оболочки КТ (6-меркаптогексадеканоата) при помощи тиольной группы металлотионеина. В результате, рутениевый донор оказывается достаточно близко к поверхности частицы для эффективного переноса электрона на нее рис. 4, из-за чего квантовый выход люминесценции точки падает приблизительно в 5 раз.
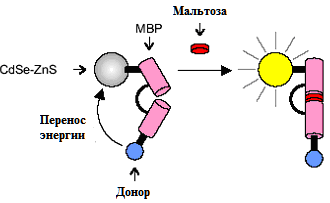
Рис. 4 Присоединение мальтозы к MBP отдаляет рутениевый донор от КТ, предотвращая перенос электрона и обеспечивая "включение" люминесценции системы
При связывании мальтозы белок значительно изменяет свою конформацию, отдаляя рутениевый донор от поверхности КТ. Благодаря этому эффективность переноса электрона падает, обеспечивая увеличение квантового выхода люминесценции квантовой точки в 1.4 раза. Таким образом, присутствие мальтозы приводит к существенному росту интенсивности люминесценции точки, хотя и не полностью восстанавливает исходное значение для свободной частицы.
Таким образом, один путь контроля люминесценции состоит в изменении расстояния от КТ до донора, и, следовательно, "включении" люминесценции в присутствии анализируемого вещества. Альтернативный способ схематически изображен на рис. 5.
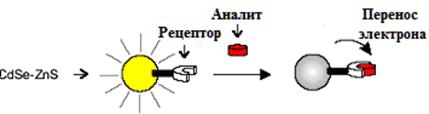
Рис. 5 Тушение люминесценции КТ после присоединения аналита к рецептору.
Присоединение анализируемого вещества (аналита) к рецептору на поверхности КТ CdSe-ZnS может приводить к переносу электрона с частицы на комплекс рецептор-аналит и, как следствие, тушению люминесценции точки. Данный путь реализован в гибридной системе, состоящей из квантовой точки типа ядро/оболочка CdSe/ZnS, поверхность которой модифицирована 1-(2-меркаптоэтил)-3-фенил-тиомочевиной, выступающей в качестве рецептора (Рис. 6) [ Sandros M. G., Gao D. and Benson D. // J. Am. Chem. Soc., 2005, 127, 12198.].
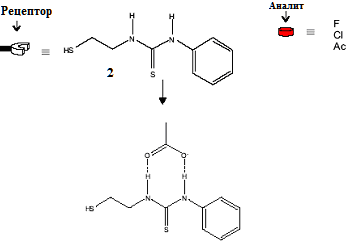
Рис. 6 Рецептор 1-(2-меркаптоэтил)-3-фенил-тиомочевина.
Система была опробована на фториде, хлориде, бромиде, гидросульфате и ацетате тетрабутиламмония. Введение ионов фтора, хлора и ацетата приводила к падению интенсивности люминесценции на 90 %, в то время как бромид - и гидросульфат-ионы не оказывали никакого влияния на люминесценцию КТ. В этом случае тушение происходило за счет увеличения восстановительного потенциала рецептора (Рис. 6) при присоединении аниона и, как следствие, увеличения эффективности переноса электрона от возбужденной частицы CdSe/ZnS к рецептору. Селективность и чувствительность данной системы сопоставима с аналогичными сенсорами на основе органических красителей, состоящих из схожих рецепторов и антрацена в качестве люминофора [ Callan J. F., Mulrooney R. C., Kamila S. and McCaughan B. //
J. Fluoresc. 2007, Online.]. Таким образом, подобный "модульный" подход дает возможность адаптировать рецепторы, использующиеся в сенсорах на основе органических красителей, к квантовым точкам и успешно использовать полученные системы [ I. Yildiz // Open Access Dissertations, 2008, Paper 103, http://scholarlyrepository. miami. edu/oa_dissertations/103 ].
Механизм переноса электрона также может быть применен для отслеживания активности ферментов. Так, например, на основе связанных с тирозином квантовых точек CdSe-ZnS были разработаны тесты для определения активности тирозиназы (Рис. 7) [ Gunnlaugsson T., Davis A., Hussey G., Tierney J., Glynn M. // Org. Biomol. Chem., 2004, 2,1856.].
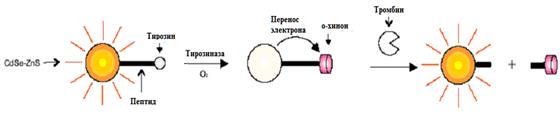
Рис. 7 Ферментативная активность тирозиназы, окисляющей тирозин до о-хинона на поверхности КТ CdSe-ZnS, и последующее тушение люминесценции КТ о-хинолином. Люминесценция КТ может быть восстановлена отщеплением о-хинона в результате воздействия тромбина.
Тирозиназа катализирует окисление тирозина (3, рис. 8) до 3-гидрокси-L-тирозина (L-DOPA, 4, рис. 8), который затем окисляется до соответствующего о-хинона (5, рис. 8). о-Хинон обеспечивает тушение люминесценции КТ и, следовательно, спектрофотометрическое обнаружение тирозина. При увеличении концентрации тирозиназы возрастает эффективность тушения излучения КТ, вплоть до 45% от первоначальной интенсивности. Предел обнаружения данного фермента таким способом составляет 0.2 мМ.
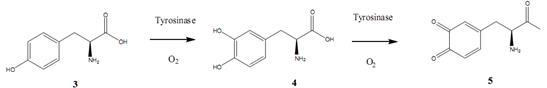
Рис. 8. Ферментативное превращение тирозина в о-хинон.
Закрепление тирозиназы вблизи поверхности КТ осуществляется стандартным для подобных биосенсоров путем - при помощи белка-связки (рис. 7). Белок содержит определенную последовательность аминокислот, которая может быть расщеплена ферментом тромбином, в результате чего тушитель отдаляется от КТ и восстанавливается интенсивность ее люминесценции. В дальнейшем возможно присоединение к белковому остатку, закрепленному на КТ, отщепленной части белка с тирозином и повторное использование системы в качестве высокочувствительного биосенсора [ Gill R., Freeman R., Xu J., Willner I., Winograd S., Shweky I. and Banin U. // Am. Chem. Soc., 2006, 128, 15376.].
Таким образом, фотоиндуцированный перенос электрона может быть использован для создания высокочувствительных сенсоров на основе систем КТ-лиганд, в том числе и для изучения ферментативной активности. Не менее успешно для этих целей могут быть применены системы, в которых тушение люминесценции происходит по другому механизму - резонансного переноса энергии
Похожие статьи
-
Полупроводниковые квантовые точки могут передавать энергию одному или нескольким подходящим акцепторам [ Clapp A., Medintz I. and Mattoussi H. //...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
Изменение люминесценции гибридных систем, состоящих из квантовой точки и фотохромного лиганда, возможно не только за счет химического воздействия, но и...
-
На рис. 20 представлены спектры поглощения растворов КТ и лиганда в хлороформе в присутствии HCl. Оптическая плотность КТ максимальна на длине волны 363...
-
Спектральные и фотохимические характеристики исходных веществ Спектральные свойства 2-(4-[9-меркаптононокси] стирил) хинолина и квантовой точки CdS На...
-
Для проверки фотоактивности и возможности управления люминесценцией гибридного соединения за счет изменения изомерного состояния органического лиганда,...
-
Спектральные свойства нейтральной формы гибридного соединения QD-L На рис. 28 представлены спектры поглощения растворов исходных квантовых точек CdS...
-
Поскольку фотостационарные состояния, полученные при облучении светом с разной длиной волны, имеют разное содержание Транс -изомера фотоактивного...
-
Фотолиз гибридного соединения QD-L в кислой среде - Свойства нейтральной формы гибридного соединения
Для проверки фотоактивности и возможности управления люминесценцией протонированной формы гибридного соединения при помощи облучения светом с различными...
-
Введение - Свойства нейтральной формы гибридного соединения
Гибридный фотохромный хемосенсор лиганд Материалы, обладающие контролируемой люминесценцией, востребованы в настоящее время в различных областях науки и...
-
Спектральные свойства протонированной формы гибридного соединения QD-L На рис. 34 представлены спектры поглощения квантовой точки CdS (QD), лиганда (LH)...
-
Выводы - Свойства нейтральной формы гибридного соединения
1. Отработана методика синтеза гибридного соединения QD-L на основе квантовой точки CdS (QD) и фотоактивного лиганда -...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
Методы расчета квантовых выходов - Свойства нейтральной формы гибридного соединения
В изучении фотоизомеризации часто случается так, что продукт реакции нельзя выделить в чистом состоянии, так как невозможно разделить реакционную смесь...
-
Для получения модифицированной квантовой точки (гибридного соединения) были использованы квантовые точки CdS (КТ, QD) с диаметром 2,5 нм и...
-
Для проверки фотоактивности нейтральной и протонированной форм лиганда был проведен его фотолиз в свободном состоянии (без квантовой точки) в хлороформе....
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Для исследования гибридной системы в случае нахождения лиганда в протонированной форме, исходный раствор гибридного соединения разбавляли до необходимой...
-
Коалесцентный механизм элементарного акта наблюдается при флотации аполярных минералов с углеводородными маслами. По данному механизму частичка, на...
-
Прагматические свойства информации - Системная революция и принцип дуального управления
Если семантические свойства информации отражают ситуационный аспект существования системы (осмысленность, оформленность ее бытия), то прагматические...
-
"Квантовая химия" Квантовая химия - область теоретической химии, в которой вопросы строения и реакционной способности химических соединений, химические...
-
Понятие квантовой химии - Квантовые концепции в химии
Квантовая химия - это раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействие и превращение в химических...
-
В 1999 исследователи из Университета Вены продемонстрировали применимость корпускулярно-волнового дуализма к таким молекулам как фуллерен Гидратированный...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
Молекулярные кристаллы фуллеренов -- полупроводники, однако в начале 1991 г. было установлено, что легирование твердого С60 небольшим количеством...
-
Сложение, вычитание, умножение комплексных чисел в алгебраической форме производят по правилам соответствующих действий над многочленами. Четность и...
-
Методы оценки параметров структурной формы модели - Основы эконометрики
Коэффициенты структурной модели могут быть оценены разными способами в зависимости от вида системы одновременных уравнений. Наибольшее распространение в...
-
Структурная и приведенная формы модели - Основы эконометрики
Система совместных, одновременных уравнений (или структурная форма модели) обычно содержит эндогенные и экзогенные переменные. Эндогенные переменные -...
-
ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. - Галлий
Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ножом) металл превратился в...
-
Сплавы. Применение алюминия и его соединений - Алюминий и его свойства
5 .1 Сплавы алюминия Алюминий всех марок содержит более 99% чистого алюминия. В зависимости от химического состава он подразделяется на алюминий особой,...
-
Особые механические свойства эластичность - способность к высоким обратимым деформациям при относительно небольшой нагрузке (каучуки); малая хрупкость...
-
Теория Периодической Системы была преимущественно создана Н. Бором (1913-21) на базе предложенной им квантовой модели атома. Учитывая специфику изменения...
-
Протонирование - механизм ионизации, при котором к молекуле присоединяется протон, сообщая ей заряд 1+ на каждый присоединенный протон. Положительные...
-
Определение необходимого объема выборки - Основы эконометрики
В практике проектирования выборочного наблюдения возникает вопрос о необходимой численности выборки, которая необходима для обеспечения определенной...
-
Объект исследования и его модель - Основы научных исследований
Объект исследования - это первичное, не сводимое к более простым, понятие. Поэтому дать его общее определение невозможно. Однако можно указать примеры...
-
Оценка времени поездки на основе моделирования транспортных потоков
Оценка времени поездки на основе моделирования транспортных потоков С. Н.Козорезова Постоянное увеличение количества транспортных заторов на...
-
Важнейшие алкалоиды. - Гетероциклические соединения. Алкалоиды
Атропин. Алкалоид, содержащийся в растениях семейства пасленовых (белена, красавка, дурман и др.). В медицине применяют в виде водных растворов...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
Комплексные соединения, их номенклатура, типы, строение, свойства - Основы химии
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Согласно...
Хемосенсоры на основе полупроводниковых квантовых точек, Хемосенсоры на основе механизма фотоиндуцированного переноса электрона - Свойства нейтральной формы гибридного соединения