Хемосенсоры на основе механизма резонансного переноса энергии - Свойства нейтральной формы гибридного соединения
Полупроводниковые квантовые точки могут передавать энергию одному или нескольким подходящим акцепторам [ Clapp A., Medintz I. and Mattoussi H. // ChemPhysChem., 2006, 7, 47.]. Для этого донор и акцептор должны находиться достаточно близко друг к другу и спектр люминесценции первого перекрываться со спектром поглощения второго. Ферстер показал, что константа скорости резонансного переноса энергии обратно пропорциональна шестой степени расстояния между донором и акцептором и выражается следующим уравнением [ Fцrster T. // Ann. Phys., 1948, 2, 55., Под ред. Н. М. Эммануэля и М. Г. Кузьмина // Экспериментальные методы химической кинетики // М.: Издательство Московского университета, 1985, с.135-136. ]:
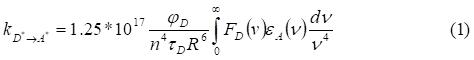
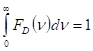
Где н - волновое число, еA - молярный коэффициент экстинкции акцептора (А), FD - спектр испускания донора (D) в шкале волновых чисел, нормированный на единицу (т. е. ), цD - квантовый выход люминесценции донора, фD - время затухания люминесценции, n - показатель преломления растворителя, R - расстояние между D и A в нанометрах.
Эффективность переноса энергии характеризуется радиусом Ферстера - критическим расстоянием между донором и акцептором, на котором вероятность переноса энергии равна вероятности спонтанной дезактивации:
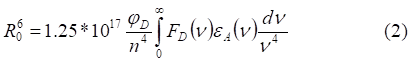
Эффективность (вероятность) ферстеровского резонансного переноса энергии (FRET) позволяет определить действительное расстояние между донором и акцептором исходя из следующего выражения [22]:
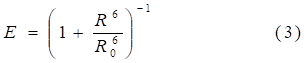
Легко видеть, что при R = R0 вероятность переноса энергии равна 50 %.
В Таблице 3 представлены ферстеровские радиусы типичных донорно-акцепторных пар, состоящих из органических красителей [ Haugland, R. P. // The Handbook: A Guide to Fluorescent Probes and Labeling Technologies // Molecular Probes: Eugene, 2005.] и квантовых точек [ Clapp, A. R.; Medintz, I. L.; Mauro, J. M.; Fisher, B. R.; Bawendi, M. G. and Mattoussi, H. // J. Am. Chem. Soc., 2004, 126, 301. , Clapp, A. R.; Medintz, I. L.; Fisher, B. R.; Anderson, G. P. and Mattoussi, H. // J. Am. Chem. Soc., 2005, 127, 1242.]. Изменение расстояния между донором и акцептором или перекрывания их спектров люминесценции и поглощения при воздействии определенных факторов позволяет управлять люминесценцией всей системы. Таким образом, становится возможным создание различных высокочувствительных сенсоров, выходным сигналом которых является люминесценция объекта.
Таблица 3. Ферстеровские радиусы донорно-акцепторных пар [28-30].
|
Донор |
Акцептор |
R0 , нм |
|
Флуоресцеин |
Тетраметилродамин |
5.5 |
|
IAEDANS |
Флуоресцеин |
4.6 |
|
EDANS |
Dabcyl |
3.3 |
|
Флуоресцеин |
Флуоресцеин |
4.4 |
|
BODIPY FL |
BODIPY FL |
5.7 |
|
Флуоресцеин |
QSY 7 |
6.1 |
|
Флуоресцеин |
QSY 9 |
6.1 |
|
CdSe/ZnS |
Cy3 |
4.7 |
|
CdSe/ZnS |
AF 488 |
6.6 |
|
CdSe/ZnS |
AF 594 |
6.1 |
|
CdSe/ZnS |
AF 680 |
8.4 |
С помощью подобных систем возможно изучение гибридизации олигонуклеотидных цепей [ Nikiforov T. and Beechem J. // Anal. Biochem., 2006, 357, 68.]. Для этого, например, олигонуклеотидная цепь с тиольной группой на 5'-конце закрепляется на поверхности квантовой точки CdSe-ZnS (Рис. 9). В присутствии комплементарной цепи, меченой красителем Texas Red (6, рис. 9) на 3'-конце происходит гибридизация с образованием соответствующей двухцепочечной ДНК. В результате КТ и органический краситель оказываются в непосредственной близости друг от друга. Хромофор 6 поглощает свет в той же области спектра, в которой излучает наночастица, благодаря чему при возбуждении КТ происходит перенос энергии с нее на краситель, что приводит к падению интенсивности люминесценции квантовой точки в 2.5 раза (длина волны возбуждения точки - 580 нм, что соответствует максимуму ее поглощения). Под воздействием ДНКазы I двойная нуклеотидная цепь расплетается и краситель 6 оказывается на большом расстоянии от КТ, в результате чего исходная люминесценция точки практически восстанавливается.
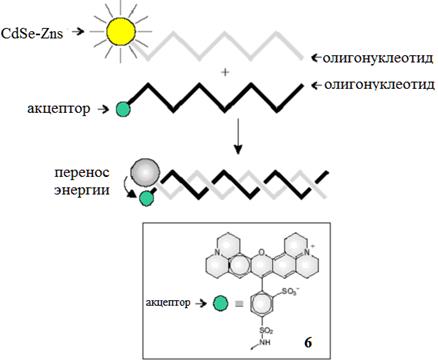
Рис. 9. Гибридизация олигонуклеотидов, связанных с КТ CdSe-ZnS и соответствующим акцептором, приводит к переносу энергии от квантовой точки к красителю и тушению люминесценции точки.
Сенсоры, тушение люминесценции которых происходит по FRET-механизму, могут быть использованы и для обнаружения молекул меньшего размера. На рис. 10 представлен принципиальная схема работы подобного сенсора [ Gill R., Willner I., Shweky I. and Banin U. // J. Phys. Chem. B., 2005, 109, 23715.]. Квантовая точка CdSe-ZnS, покрыта инертным и фотоактивным лигандами. Инертным лигандом является дигидролипоевой кислота, фотоактивным - антитело, способное распознавать и связывать
2,4,6-тринитротолуол (ТНТ). Антитело закрепляется на КТ при помощи присоединенного олигогистидинового остатка, который взаимодействует с катионами цинка на поверхности точки.
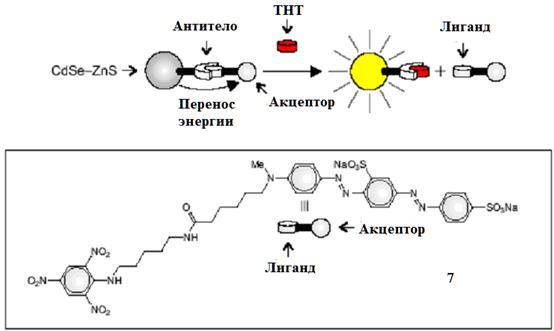
Рис. 10 Взаимодействие ТНТ с антителом отдаляет акцептор 8 от КТ, предотвращая перенос энергии и "включая" люминесценцию точки.
Добавление соединения 7 приводит к ассоциации его 2,4,6-тринитрофенилльной части с системой антитело-наночастица. Значительная р-Система противоположного конца молекулы 7 поглощает свет в той же области, в которой КТ излучает. В результате происходит перенос энергии с возбужденной квантовой точки на нелюминесцирующий хромофор 7 и падение интенсивности люминесценции КТ в 2.5 раза. В то же время, ТНТ отделяет соединение 7 от антитела и закрепляется на нем вместо
2,4,6-тринитрофенильной части акцептора. Как следствие, перенос энергии подавляется, и люминесценция квантовой точки значительно усиливается в соответствии с увеличением концентрации ТНТ. Таким образом, данный механизм дает возможность количественно и качественно определять ТНТ.
Схожий процесс может быть использован для анализа ферментативной активности. Например, поверхность квантовой точки CdSe-ZnS модифицируется пептидом с родаминовым красителем на конце (8, рис. 11) [ Shi L., De Paoli V., Rosenzweig N. and Rosenzweig Z. // J. Am. Chem. Soc., 2006, 128, 10378.]. В результате возбуждение наночастицы сопровождается эффективным переносом энергии на органический краситель 8 и в спектре люминесценции системы присутствуют пики КТ (545 нм) и родаминового акцептора (590 нм).
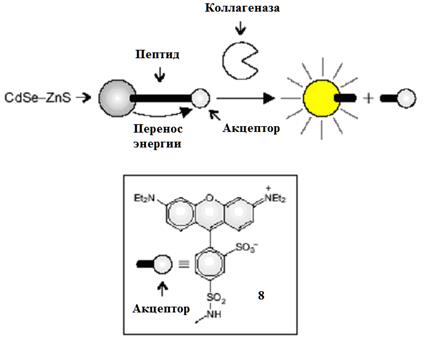
Рис. 11. Коллагеназа расщепляет пептидный мостик между КТ и родаминовым акцептором 9, подавляя перенос энергии и "включая" люминесценцию точки.
При добавлении коллагеназы происходит ферментативное расщепление пептидного мостика между КТ и акцептором и, соответственно, увеличение расстояния между ними. При этом интенсивность люминесценции на длине волны 545 нм (КТ) возрастает, а на 590 нм (краситель) - падает. Таким образом, ферментативное расщепление пептидной связки может быть превращено в измеряемый люминесцентный сигнал.
Кроме того, квантовые точки могут выступать в качестве эффективных доноров для определения целевых веществ, таких как мальтоза, при помощи мальтоза-связывающего белка (maltose-binding protein, MBP) [ Medintz I., Clapp A., Mattoussi H., Goldman E. and Mauro B.// J. M. Nat. Mater, 2003, 2, 630.]. Возможно использование наночастиц CdSe-ZnS в качестве биосенсоров с двухступенчатым механизмом переноса энергии, что позволяет избежать неотъемлемых ограничений по расстоянию между донором и акцептором. В системе, представленной на рис. 12, MBP, связанный с цианиновым красителем Cy3, адсорбирован на поверхности КТ (QD 530, рис. 12) посредством гистидиновых групп, при этом происходит перенос энергии с КТ на Cy3.
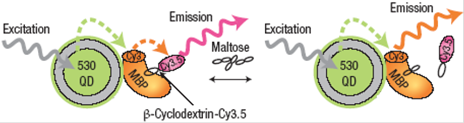
.
Рис. 12. Перенос энергии на множественные акцепторы с донорной КТ, связанной с белком.
Известно, что - циклодекстрин (-CD, рис. 12) может помещаться в центральном субстрат-связывающем кармане MBP. Таким образом, соединенный с - циклодекстрином цианиновый краситель Cy3.5 присоединяется к ферменту, обеспечивая вторичный перенос энергии с Cy3 на Cy3.5. Возбуждение квантовой точки приводит к переносу энергии с КТ на Cy3.5 через MBP-Cy3, который значительно превосходит прямой перенос энергии КТ-Cy3.5. в результате, при возбуждении КТ наблюдается люминесценция Cy3.5 (594 нм). Мальтоза вытесняет - циклодекстрин из центрального субстрат-связывающего кармана MBP, что приводит к прекращению переноса энергии с Cy3 на Cy3.5. После добавления мальтозы при возбуждении КТ наблюдается люминесценция Cy3 (570 нм)
Похожие статьи
-
Гибридные системы на основе квантовых точек (КТ) и органических лигандов могут быть использованы в качестве хемо-, био - и фотосенсоров, а также...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
Спектральные свойства нейтральной формы гибридного соединения QD-L На рис. 28 представлены спектры поглощения растворов исходных квантовых точек CdS...
-
Изменение люминесценции гибридных систем, состоящих из квантовой точки и фотохромного лиганда, возможно не только за счет химического воздействия, но и...
-
На рис. 20 представлены спектры поглощения растворов КТ и лиганда в хлороформе в присутствии HCl. Оптическая плотность КТ максимальна на длине волны 363...
-
Спектральные свойства протонированной формы гибридного соединения QD-L На рис. 34 представлены спектры поглощения квантовой точки CdS (QD), лиганда (LH)...
-
Для проверки фотоактивности и возможности управления люминесценцией гибридного соединения за счет изменения изомерного состояния органического лиганда,...
-
Фотолиз гибридного соединения QD-L в кислой среде - Свойства нейтральной формы гибридного соединения
Для проверки фотоактивности и возможности управления люминесценцией протонированной формы гибридного соединения при помощи облучения светом с различными...
-
Спектральные и фотохимические характеристики исходных веществ Спектральные свойства 2-(4-[9-меркаптононокси] стирил) хинолина и квантовой точки CdS На...
-
Поскольку фотостационарные состояния, полученные при облучении светом с разной длиной волны, имеют разное содержание Транс -изомера фотоактивного...
-
Введение - Свойства нейтральной формы гибридного соединения
Гибридный фотохромный хемосенсор лиганд Материалы, обладающие контролируемой люминесценцией, востребованы в настоящее время в различных областях науки и...
-
Выводы - Свойства нейтральной формы гибридного соединения
1. Отработана методика синтеза гибридного соединения QD-L на основе квантовой точки CdS (QD) и фотоактивного лиганда -...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
Для получения модифицированной квантовой точки (гибридного соединения) были использованы квантовые точки CdS (КТ, QD) с диаметром 2,5 нм и...
-
Методы расчета квантовых выходов - Свойства нейтральной формы гибридного соединения
В изучении фотоизомеризации часто случается так, что продукт реакции нельзя выделить в чистом состоянии, так как невозможно разделить реакционную смесь...
-
Для проверки фотоактивности нейтральной и протонированной форм лиганда был проведен его фотолиз в свободном состоянии (без квантовой точки) в хлороформе....
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Для исследования гибридной системы в случае нахождения лиганда в протонированной форме, исходный раствор гибридного соединения разбавляли до необходимой...
-
Структурная и приведенная формы модели - Основы эконометрики
Система совместных, одновременных уравнений (или структурная форма модели) обычно содержит эндогенные и экзогенные переменные. Эндогенные переменные -...
-
ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. - Галлий
Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ножом) металл превратился в...
-
Комплексные соединения, их номенклатура, типы, строение, свойства - Основы химии
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Согласно...
-
Самоорганизация сложных систем - Основы естественно-научных знаний
Синергетика - теория самоорганизации. Она возникла на основе современных глобальных тенденций объединении всех естественнонаучных дисциплин и занимается...
-
Прагматические свойства информации - Системная революция и принцип дуального управления
Если семантические свойства информации отражают ситуационный аспект существования системы (осмысленность, оформленность ее бытия), то прагматические...
-
Случайные события и случайные величины - Основы научных исследований
Вероятностные закономерности проявляются только в массовых явлениях, т. е. когда один и тот же объект изменяет свое состояние многократно или когда...
-
Объект исследования и его модель - Основы научных исследований
Объект исследования - это первичное, не сводимое к более простым, понятие. Поэтому дать его общее определение невозможно. Однако можно указать примеры...
-
Исследования, проводимые в последние годы, указывают на перспективность использования систем, для которых характерна фотоинициируемая валентная...
-
Соединения азота - Азот, его соединение и свойства. Азот в природе
Из почвы соединения азота попадают в растения. Далее: "лошади кушают овес", а хищники -- травоядных живот-ных. По пищевой цепи идет круговорот вещества,...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Особые механические свойства эластичность - способность к высоким обратимым деформациям при относительно небольшой нагрузке (каучуки); малая хрупкость...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
Сплавы. Применение алюминия и его соединений - Алюминий и его свойства
5 .1 Сплавы алюминия Алюминий всех марок содержит более 99% чистого алюминия. В зависимости от химического состава он подразделяется на алюминий особой,...
-
Молекулярные кристаллы фуллеренов -- полупроводники, однако в начале 1991 г. было установлено, что легирование твердого С60 небольшим количеством...
-
Методы оценки параметров структурной формы модели - Основы эконометрики
Коэффициенты структурной модели могут быть оценены разными способами в зависимости от вида системы одновременных уравнений. Наибольшее распространение в...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
Как компонент термита, смесей для алюмотермии Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов Сплавы на основе...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Введение Нильс Бор принадлежит к числу самых известных исследователей современности. Среди значительных ученых, работавших в области точного...
Хемосенсоры на основе механизма резонансного переноса энергии - Свойства нейтральной формы гибридного соединения