Энергия кристаллической решетки. Типы кристаллов: молекулярные, ковалентные, ионные и металлические - Систематика химических элементов
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические.
В соответствии с этой классификацией важной характеристикой кристаллов является Энергия кристаллической решетки. Ее определяют как энергию, которую необходимо затратить на разрушение данного кристалла и удаление образующих его частиц за пределы их взаимодействия. Энергию кристаллической решетки обычно измеряют в кДж и относят к 1 моль вещества кристаллической решетки.
Молекулярные кристаллы
Структурными единицами являются молекулы, связанные друг с другом либо вандерваальсовыми силами, либо водородными связями. Малая энергия межмолекулярного взаимодействия, т. е. низкая энергия кристаллической решетки, определяет набор физических свойств кристаллов этого типа: низкую прочность, низкую температуру плавления, высокую летучесть, очень низкие электропроводность и теплопроводность.
Наиболее низкой энергией кристаллической решетки обладают вещества с Неполярными молекулами: благородные газы, галогены, а также CO2, CH4, ВF3. Связь в подобных кристаллах между молекулами осуществляется Дисперсионной составляющей сил Ван-дер-Ваальса.
С увеличением электрического момента диполя молекул, образующих кристалл, увеличивается энергия кристаллической решетки, поэтому наибольшим значением энергии кристаллической решетки обладают кристаллы, между молекулами которых реализуются водородные связи: НСl, NН3, H2O.
Одна из специфических особенностей молекулярных кристаллов заключается в том, что в силу незначительной энергии межмолекулярного взаимодействия молекулы сохраняют свою химическую индивидуальность.
Поскольку силы Ван-дер-Ваальса являются ненаправленными, то для молекулярных кристаллов со сферическими частицами характерна структура плотнейшей упаковки в обоих вариантах - кубическая, в которую кристаллизуются все благородные газы, кроме Не, и гексагональная (Не, N2, H2).
Для молекул несферической формы наблюдается искажение плотнейшей упаковки. Наибольшего отличия эти искажения достигают у молекулярных кристаллов с водородными связями, поскольку водородные связи имеют направленный характер, что снижает значение координационного числа до 4.
Расстояние между молекулами в молекулярных кристаллах достаточно велико и достигает 3,5 - 4А (1 А =10-10 м).
Ковалентные кристаллы
Структурными единицами являются атомы одного или нескольких элементов, связь между которыми носит ковалентный характер. В ковалентных кристаллах валентные электроны соседних атомов обобществлены, образуя мостики электронной плотности между атомами.
Ковалентные кристаллы сравнительно немногочисленны: С, Si, Ge, Sn, SiC, Al4N3, ZnS.
Энергия кристаллической решетки практически совпадает с энергией ковалентной связи и лежит в диапазоне 200 -500 кДж/моль.
Вследствие высоких значений энергии кристаллической решетки ковалентные кристаллы обладают высокими температурами кипения и плавления, высокой твердостью. Диапазон их электропроводящих свойств достаточно широк: от типичных диэлектриков, каковым является алмаз, через полупроводники Si и Ge к металлу, каким является Sn (серое).
Ковалентный кристалл можно рассматривать как одну гигантскую молекулу. Координационное число большинства ковалентных кристаллов не превышает 4; это означает, что каждый атом в кристалле образует четыре направленные ковалентные связи. Направленность связи искажает для ковалентных кристаллов плотнейшую упаковку.
Ионная связь. Ионные кристаллы
Связь называется Ионной, если она осуществляется путем электростатического взаимодействия разноименно заряженных ионов, образовавшихся при смещении электронов от одного атома к другому.
Ее можно рассматривать как предельный случай ковалентной полярной связи. Ионная связь может возникать только в том случае, если различия в электроотрицательности взаимодействующих атомов достаточно велики.
Если разность относительных электроотрицательностей взаимодействующих атомов Х равна 0, то образуется ковалентная неполярная связь; если 0<х<2 - Ковалентная полярная; если Х> 2-Ионная связь.
Поскольку электростатическое поле иона имеет сферическую симметрию, то ионная связь не обладает направленностью.
Взаимодействие двух заряженных ионов не приводит к полной компенсации их полей, поэтому ионная связь не обладает насыщаемостью.
Для ионной связи эффективные заряды атомов 1. Химическая связь не может быть на 100% ионной. Долю ионного характера связи называют Степенью ионности, которая количественно характеризуется эффективными зарядами атомов в молекуле.
Таким образом, природа химической связи едина, и существующее различие между видами связи имеет количественный характер.
Кристаллические решетки кристаллов этого типа состоят из чередующихся положительно и отрицательно заряженных ионов, между которыми действуют электростатические силы притяжения.
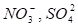
Ионные кристаллы образуются при взаимодействии атомов, имеющих большую разность электроотрицательностей. Примерами ионных кристаллов являются галогениды щелочных (NaСl, KF) или щслочно-земельных (СаF2) металлов. В состав ионных кристаллов могут входить и сложные ионы: .
Энергия кристаллической решетки достигает высоких значений (для NaСl: 770 кДж/моль); это, в свою очередь, обусловливает следующий набор физических свойств: высокую твердость, хрупкость. Высокие температуры плавления и кипения, высокие теплоты плавления. Подобные свойства определены не только значительной энергией кристаллической решетки, но и структурой каркаса ионного кристалла.
Многие ионные кристаллы относят к классу диэлектриков; при комнатной температуре их электропроводность на 20 порядков ниже, чем электропроводность металлов. С увеличением температуры электропроводность ионных кристаллов возрастает.
Во многих ионных кристаллах наряду с электростатическим притяжением действуют ковалентные связи, а также силы Ван-дер-Ваальса, причем присутствие ковалентной связи вызывает определенные отклонения в физико-химических свойствах кристаллов этого типа, которые не объясняются электростатической моделью.
Наименьшее влияние ковалентности наблюдается для кристаллов галогенидов щелочных металлов.
Так как ионная связь не имеет направленного характера, а многим ионам можно приписать сферическую форму, то структура большинства ионных кристаллов тождественна структурам плотнейшей упаковки.
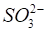
Вещества ионной природы с многоатомными ионами также образуют ионные кристаллы. Это наблюдается даже для таких ионов, как, которые имеют тригональную симметрию.
Металлические кристаллы
Более 80 из 114 элементов периодической системы обладают металлическими свойствами. К металлическим элементам относятся все s-элементы (кроме Н и Не), все D- и f-элементы, а также часть p-элементов.
Металлические свойства определяются высокими значениями электропроводности и теплопроводности, тягучестью и ковкостью, металлическим блеском, а также высокой отражательной способностью в видимой части спектра.
По энергии кристаллической решетки металлы занимают промежуточное положение между молекулярными и ковалентными кристаллами.
Чрезвычайно высокие значения по сравнению с другими типами кристаллов электропроводности и теплопроводности указывают на высокую подвижность и большую "свободу" электронов в пространственной структуре кристалла.
С точки зрения теории строения атомов, характерные металлические свойства проявляют вещества, образованные элементами с небольшим числом валентных электронов и значительным числом вакантных орбиталей на последнем энергетическом уровне.
За счет этих особенностей при кристаллизации атомы будут укладываться с максимально возможной плотностью, чтобы их незаполненные орбитали оказались заселены валентными электронами.
Таким образом, валентные электроны участвуют в образовании связей сразу с 8 или 12 атомами. В этих условиях валентные электроны с небольшой энергией ионизации перемещаются по доступным орбиталям всех соседних атомов, обеспечивая связь между ними. Валентные электроны в металлических кристаллах являются нелокализованными. Такая нелокализованная связь называется Металлической связью. Для ее описания используется модель "свободного электрона", согласно которой в узлах кристаллической решетки находятся катионы, погруженные в "электронный газ" из нелокализованных электронов. Устойчивость такой системы объясняется силами притяжения между катионной решеткой и "электронным газом", движение которого подчиняется классическим законам движения газообразных молекул.
С увеличением температуры увеличивается амплитуда колебаний катионов, а значит, уменьшается длина свободного пробега электронов в кристалле, что приводит к снижению его электрической проводимости.
Большинство металлов в силу ненаправленного характера металлической связи кристаллизуются в структуры плотнейшей упаковки.
Расстояние между частицами кристаллов с металлической ковалентной и ионной связями составляет 1,5-2,5 А.
Похожие статьи
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
Тепловые эффекты при растворении. Механизмы растворения веществ в воде - Растворы
Растворение веществ сопровождается различными тепловыми эффектами в зависимости от природы вещества. При растворении в воде, например, гидроксида калия...
-
Металлические стекла - Металлы и сплавы в химии и технике
В самом начале этого реферата мы выяснили, что при обычных условиях затвердевания жидкого металла его атомы образуют кристаллическую решетку того или...
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Новый класс металлорганических соединений, имеющий двухслойную структуру, называется "сэндвичевые соединения". Наиболее изученным из них является...
-
Математически строго аддитивны только массы смешиваемых тел, но иногда аддитивные объемы, а также молекулярные массы. Касаемо структуры молекул, правило...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Если атом находится в основном (т. е. в невозбужденном) состоянии, то его электроны занимают самые низкие по энергиям орбитали. Однако в многоэлектронном...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Во внешнем слое атомов кремния содержится 4 электрона - столько, сколько не хватает до завершения этого слоя. Углерод и кремний относятся к неметаллам....
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
Периодический закон химических элементов: свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической...
-
Фуллериты Конденсированные системы, состоящие из молекул фуллеренов, называются фуллеритами. Наиболее изученная система такого рода -- кристалл С60,...
-
Применение Таллия. - Третья группа периодической системы
В технике Таллий применяется главным образом в виде соединений. Монокристаллы твердых растворов галогенидов TlBr - TlI и TlCl - TlBr (известные в технике...
-
Химические свойства - Свойства азота
Азот находиться в верхнем правом углу периодической системы, в котором сосредоточены неметаллы с наибольшими сродствами к электронам. Поэтому он должен...
-
ВВЕДЕНИЕ, СТРОЕНИЕ МОЛЕКУЛ И СВОЙСТВА ВОДЫ - Химические свойства и строение воды
Вода - ценнейший природный ресурс. Вода играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Полоний - Химия элементов VI группы
Полоний - радиоактивный химический элемент 16-й группы, 6-го периода в периодической системе Д. И. Менделеева, с атомным номером 84, обозначается...
-
Введение - Структура и свойства металлических расплавов
Расплавленные металлы и сплавы составляют группу металлических жидкостей. Межчастичные связи в них возникают преимущественно вследствие взаимодействия...
-
В этой работе описаны общая характеристика пероксидов щелочных металлов, их химические и физические свойства, а также их получение. Особое внимание...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
ЖИДКИЕ КРИСТАЛЛЫ -- НОВОЕ СОСТОЯНИЕ ВЕЩЕСТВА. - Жидкие кристалы
Многообразие жидких кристаллов. Теперь обратим внимание на то, что сказать о каком-то веществе: просто жидкий кристалл, это еще слишком мало. И если...
-
Иоганн Вольфганг Деберейнер - Становление понятия о химическом элементе
Деберейнер изучал химические явления с точки зрения материалистических позиций, исходя из положений атомистической теории. Методологической основой своих...
-
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
По химическим свойствам галлий сходен с алюминием. На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком,...
-
Представления Лотара Мейера - Становление понятий о химическом элементе
Попытки систематизации многочисленных известных элементов и соединений, начатые Деберейнером, продолжили многие известные химики. Б. Шанкартуа расположил...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Представления Йенса Якоба Берцелиуса - Становление понятий о химическом элементе
Особенно большое значение имели работы шведского химика Берцелиуса, который дал более точные определения атомных масс. Уже до Берцелиуса Дальтон...
-
Магнийорганические соединения. - Химический элемент Магний
Соединения магния с органическими кислотами. Ацетат магния Mg(CH3COO)2 - хорошо растворимое в воде соединение. Оксалат магния MgC2O4 - труднорастворимое...
-
Йенс Якоб Берцелиус - Становление понятия о химическом элементе
Особенно большое значение имели работы шведского химика Берцелиуса, который дал более точные определения атомных масс. Уже до Берцелиуса Дальтон...
-
Второе начало термодинамики. Энтропия Из предыдущих глав мы знаем много обратимых процессов, но есть и необратимые, например: - переход тепла от горячего...
-
Введение, Общая характеристика химического элемента, Физические свойства - Биогенные элементы. Сера
Семра -- элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16....
Энергия кристаллической решетки. Типы кристаллов: молекулярные, ковалентные, ионные и металлические - Систематика химических элементов