Физические и химические свойства воды - Оценка показателей количественного содержания хрома в реке Москва
Физические свойства воды.
В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов Цельсия, а температурой кипения воды 100 градусов.
Всем известно, что замерзание водоема происходит только в верхней толще воды. Благодаря этому явлению, подводный мир, остающийся на зимовье, "засыпает", но не погибает, что могло бы произойти при полном промерзании водоема. Это уникальное свойство воды обусловлено тем, что при температуре в 4 градуса по Цельсию, вода имеет наивысшую плотность. Вода отдает свое тепло, нагревая воздух, и тем самым охлаждается, холодный слой воды имеет более высокую плотность и стремится опуститься на более низкий уровень, вытесняя тем самым более теплые водяные слои, имеющее меньшую плотность. Этот процесс мог бы продолжаться до бесконечности, до полного замерзания водоема, но этого не наступает, так как в любом случае температура охлаждения воды когда-нибудь достигает отметки +4 градуса тепла и вступает в силу "аномальное" явление - предельная плотность, после этого обмен слоев воды заканчивается.
При дальнейшем понижении температуры менее плотные (верхние) слои воды будут образовывать крепкую ледяную корку, нижняя часть которой не будет таять при соприкосновении с жидкой водой, так как она будет иметь температуру в 0 градусов по Цельсию. Ледяная корка выполняет защитную функцию от поступления дополнительного тепла, и поэтому при нуле градусов вода может находиться в двух состояниях одновременно - жидком и твердом. Надо отметить, что ближе ко дну водоема, вода будет намного теплее, чем на поверхности. Существует зависимость - чем больше глубина водоема, тем меньше он промерзает, в мелководных водоемах, имеющих тенденцию к полному промерзанию, виживают лишь отдельные организмы, имеющие споровую защитную структуру.
Если принять за константу, что плотность воды равна 1, то плотность льда будет равна 0,91. Подобные вычисления помогают узнавать толщину плывущей льдины.
Это становится очень актуальным для рыболовных судов и морских грузоперевозок, осуществляемых на территориях Крайнего Севера, Южного и Северного полюсов, так как эти природные регионы просто наводнены айсбергами и торосами, которые могут вызвать, при столкновении с ними, поломки или полное крушение судна. Еще одна особенность при нагревании характерна для воды - любое горячее тело, нагревается тяжелее, чем холодное, так как поглощает намного больше тепла. Этот закон не относится к воде. При нагревании воды от 0 градусов ее теплоемкость падает, при температуре 28 градусов тепла, значение теплоемкости воды становится наименьшим. Становится не очень понятно, как же быть с понятием "калория". Дело в том, что в технических характеристиках используются свойства не простой воды, а чистой, которую нагревают в температурном диапазоне от 14,5 градусов тепла до 15.5 (понятие пятнадцатая калория).
Значение это очень близко к нагреванию обычной воды, от 0 до 100 градусов по Цельсию.
Переход воды в состояние водяного пара. Пар образуется посредством испарения воды и состоит из мельчайших частиц, которые незаметны для глаза. Процесс испарения воды в природе происходит круглогодично. Процесс парообразования ускоряется при повышении температуры. Молекула ее состоит из двух атомов водорода и одного атома кислорода().
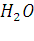
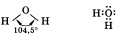
Химические свойства воды.
Вода - это самый уникальный природный растворитель, который только существует на нашей планете. Вода растворяет в себе неимоверное количество элементов, образуя различные химические соединения, служащие во благо человечества. Это отличительное свойство воды приводит к тому, что абсолютно чистой воды в природе не существует.
Помимо твердых веществ, вода так же растворяет различные газы. Если сравнить воздух, выделенный из воды и воздух, которым мы дышим, то он будет разительно отличаться. Воздух выделенный из воды значительно сильнее обогащен кислородом (63% - азот, 36% - кислород, атмосферный воздух содержит 78% азота и 21% кислорода).. Понятие жесткости воды напрямую зависит от количества растворенных в ней минеральных веществ. Чем веществ больше, тем и жесткость воды выше. Жесткость воды подразделяется на карбанатную, некарбанатную и общую. Временная жесткость определяется наличием в воде двууглекислых солей магния, железа и кальция - это слабые химические соединения, легко разрушаемые и выпадающие в осадок. Постоянная жесткость определяет наличие хлористых и сернокислых солей магния, натрия, калия, кальция, эти соли имеют устойчивую химическую природу и при кипячении не образуют осадка, а значит не разрушаются. Самыми вредными считаются сернокислые и хлористые соли магния (при кипячении они образуют соляную и серную кислоту, очень вредную для здоровья всего живого мира флоры и фауны, а так же и человека). ион хром реактив водный
Вещества, полученные путем кристаллизации при участии воды - называются кристаллогидратами, их молекулярное взаимодействие происходит самостоятельно или частично замещено, молекулы воды входят в таких веществах в их кристаллические решетки. Вода, которая входит в состав кристаллов в строго определенном количестве, называется кристаллизационной (медный купорос). Особое свойство такой воды - она имеет все свойства твердых кристаллов вещества, в составе которых находится (сахар, соль, сода). Некоторые такие кристаллические соединения очень непрочны, например сода, она легко теряет свою кристаллизационную воду - в науке такой процесс называют выветриванием.
Химические процессы в природе проходят постоянно, некоторые из них настолько медленны, что не заметны для наружного наблюдения.
Для ускорения таких химических процессов существуют различные вещества, которые называются катализаторами. Вода один из самых мощных и сильных катализаторов. Посредством воды появляется ржавчина на железе, взрыв гремучего газа так же может произойти только при участии воды.
Похожие статьи
-
Характеристика ионов хрома - Оценка показателей количественного содержания хрома в реке Москва
Соединения хрома являются тяжелыми металлами, в поверхностные воды попадают при выщелачивании из пород, некоторые количества поступают из почв в процессе...
-
Отбор проб воды является очень существенным этапом в экоаналитическом контроле. Ошибки, возникающие при отборе проб, как правило, исправить не удается....
-
Требования безопасности перед началом работы Требования безопасности перед началом работы 1. Перед проведением экспериментальной работы каждый должен...
-
Проба брал на ГПУ г. Москвы "Природный заказника "Воробъевы горы"из реки Москва, с помощью стеклянной бутыли. Затем стеклянную бутыль опускал в реку и...
-
Фотоэлектроколориметрические методы относятся к объективным методам, так как интенсивность окраски растворов оценивают с помощью специальных устройств -...
-
Выводы, Литература - Оценка показателей количественного содержания хрома в реке Москва
Было провидено отбор пробы на содержания ионов хрома на Москва-реке ГПУ г. Москвы "Природный заказника "Воробъевы горы"" и по результатам было выявлено....
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Характеристика реки Москва Москва-река - левый приток Оки, ее длина достигает 502 километра, площадь бассейна 17600 квадратных километров. Ее ширина в...
-
Введение - Оценка показателей количественного содержания хрома в реке Москва
Цель данной курсовой работы заключается в определении содержания ионов хрома на Москва-реке ГПУ г. Москвы "Природный заказника "Воробъевы горы"". Для...
-
Физические и химические свойства - Магний и его сплавы. Резиновые материалы. Быстрорежущая сталь
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой...
-
Получение, Изотопы, Физические свойства, Химические свойства - Краткие сведения о кобальте
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для...
-
УМЯГЧЕНИЕ И ОБЕССОЛИВАНИЕ ВОДЫ - Химические свойства и строение воды
Под умягчением воды подразумевается процесс удаления из нее катионов жесткости, т. е. кальция и магния. В соответствии с ГОСТ 2874-82 "Вода питьевая"...
-
Получение синтезированного газа - Анализ и технологическая оценка химического производства
Химические методы переработки нефти проводят при высоких температурах без катализатора (термический крекинг), при высоких температурах в присутствии...
-
Химические свойства кремнийорганических полимеров - Кремнийорганические полимеры
Силоксаны содержат два или более атомов кремния, связанных посредством одного или нескольких атомов кислорода: Два атома кремния, связанные таким...
-
Полимерами называют вещества, макромолекулы которых состоят из многочисленных элементарных звеньев одинаковой структуры. Полимеры встречаются в природе -...
-
3. Физические свойства, Химические свойства - Золото
Чистое золото - мягкий металл желтого цвета. Красноватый оттенок некоторым изделиям из золота, например: монетам придают примеси других металлов, в...
-
Физические свойства, Общая химическая характеристика кадмия - История открытия и свойства кадмия
Кадмий _ Серебристо-белый , отливающий синевой Металл , тускнеющий на воздухе из-за образования защитной пленки оксида. Температура плавления - 321C,...
-
Химическое строение, физико-химические и физические свойства лекарственных средств Свойства лекарственных средств в значительной степени обусловлены их...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде...
-
Приборы, реактивы, материалы и посуда Приборы Ч КФК-2МП Ч Технические весы Ч Аналитические весы Реактивы Ч Дифенилкарбозид Ч Фосфорная кислота () Ч...
-
Физические свойства., Химические свойства. - Третья группа периодической системы
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло - и электропроводностью. Алюминий имеет невысокую плотность -- примерно...
-
Физические и химические свойства - Сера и ее роль в жизни
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S-S составляет...
-
СВОЙСТВА., ФИЗИЧЕСКИЕ СВОЙСТВА. - Галлий
ФИЗИЧЕСКИЕ СВОЙСТВА. Галлий - относительно мягкий, ковкий металл, блестящего серебристого цвета с голубовато-серыми штрихами. Он плавится при 29,78 С...
-
Физические свойства - Свойства аминокислот
Аминокислоты -- бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом. Химические свойства: Все...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Водород - двухатомный газ Н2. Он не имеет ни цвета, ни запаха. Это самый легкий газ. Благодаря этому свойству он использовался в аэростатах, дирижаблях и...
-
Получение, Физические свойства, Химические свойства - Кальций и его биологическая роль
Свободный металлический кальций получают электролизом расплава, состоящего CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим...
-
КОЛЛОИДНЫЕ ВЕЩЕСТВА ПРИРОДНЫХ ВОД И ИХ УДАЛЕНИЕ - Химические свойства и строение воды
Очистка сточных вод -- лишь одно из направлений защиты гидросферы, прежде всего, поверхностных вод от антропогенных загрязнений. Главный путь защиты...
-
ЖЕСТКОСТЬ ВОДЫ - Химические свойства и строение воды
Жесткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния, это...
-
Технология производства соляной кислоты - Анализ и технологическая оценка химического производства
Соляная кислота--бесцветная жидкость, представляющая собой раствор хлористого водорода в воде. Она энергично растворяет многие металлы и их окислы. В...
-
Кремний - элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14....
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
Химические свойства Алюминия. - Третья группа периодической системы
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1. В обычных условиях Алюминий в соединениях 3-валентен, но при...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Физические свойства, Химические свойства - Арены. Толуол
Бензол и его ближайшие гомологи - бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако...
-
Физико-химические свойства кремния - Физические и химические свойства кремния
Кремний - это мелкий бурый порошок или серые, твердые, но довольно хрупкие кристаллы (пл. 2,4). В кристаллическом состоянии кремний хорошо проводит...
-
Кремний - камень, дающий огонь - Физические и химические свойства кремния
Третьим элементом, наиболее распространенным в природе, является кремний. Название этого элемента произошло от латинского "ляпис креманс", что значит -...
Физические и химические свойства воды - Оценка показателей количественного содержания хрома в реке Москва