Гальванический элемент Даниэля-Якоби. Электродвижущая сила элемента - Систематика химических элементов
Гальванический элемент Даниэля-Якоби
Гальванический элемент Даниэля-Якоби состоит из двух электродов, которые находятся в растворах собственных ионов, в частности, из медной пластинки, погруженной в раствор СuSO4. и цинковой пластинки, погруженной в раствор ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
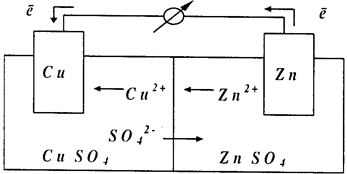
Рис. 19
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие следующего типа:
Zn Zn2+ + 2з.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие следующего вида:
Cu Cu2+ + 2з.
В результате возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного, поэтому при замыкании внешней цепи электроны будут переходить с цинкового электрода на медный. В результате этого перехода происходит перераспределение электронов. и равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. На медном электроде равновесие сместится влево, и произойдет дополнительный разряд ионов меди.
Таким образом, при замыкании внешней цепи возникает самопроизвольный процесс растворения цинка на цинковом электроде и выделение меди на медном электроде. Эти процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов, или не растворится весь цинк, или не высадится вся медь.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
1. Реакция окисления цинка
Zn - 2з Zn2+.
Процессы окисления в электрохимии получили название Анодных процессов, а электроды, на которых протекают эти процессы, называются Анодами.
2. Реакция восстановления ионов меди.
Процессы восстановления в электрохимии получили название Катодных процессов, а электроды, на которых идут эти процессы, получили название Катодов.
- 3. Перенос электронов во внешней цепи. 4. Движение ионов в растворе:
Анионов SO42 --к аноду;
Катионов Zn2+, Си 2+ - к катоду.
Суммируя электродные реакции, получим
Zn + Cu2+= Zn2+ + Cu.
Вследствие протекания этой реакции в гальваническом элементе возникает движение электронов во внешней цепи, т. е. электрический ток. Поэтому суммарная реакция в гальваническом элементе называется Токообразующей.
При схематической записи гальванического элемента границу раздела между проводником первого рода и проводником второго рода изображают одной вертикальной чертой, а границу раздела между проводниками второго рода - двумя чертами:
(Анод) Zn | Zn2+ | | Cu2+ | Cu (Катод).
С помощью гальванического элемента можно совершить электрическую работу за счет энергии химической реакции.
Электродвижущая сила элемента
Электрическая работа равна произведению разности потенциалов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется Электродвижущей силой элемента. Она равна разности равновесных потенциалов катода и анода элемента.
Максимальная электрическая работа гальванического элемента при превращении одного моль вещества выражается следующей формулой:
АМэ = nFEЭ, (55)
Где п - Количество вещества;
F - Число Фарадея;
ЕЭ - ЭДС гальванического элемента.
С другой стороны, максимальная полезная работа, которую может совершить система при протекании реакции в условии постоянства давления, равна убыли энергии Гиббса:
AМр = - ДG. (56)
Так как АМ э = АМ р, то
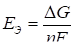
. (57)
Изменение энергии Гиббса реакции зависит от активностей или от парциальных давлений всех участников реакции.
BB + dD lL + mM.
Для реакции вида изменение энергии Гиббса, по уравнению Вант-Гоффа, запишется следующим образом:
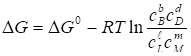
, (58)
Где AG°-стандартная энергия Гиббса.
Для газообразных реагентов активность заменяется парциальными давлениями.
Подставляя (58) в (57), получим
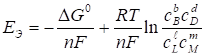
. (59)
При стандартных условиях, т. е. при равенстве активностей единице, получим
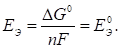
(60)
Где ЕЭ0 - стандартная ЭДС гальванического элемента.
Из уравнения (59) и (60) получим окончательно уравнение для ЭДС элемента:
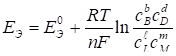
. (61)
Стандартная ЭДС элемента - Это ЭДС элемента, если относительные парциальные давления всех участков реакции равны единице.
Похожие статьи
-
Электрохимические процессы, Электродный потенциал - Систематика химических элементов
Электродный потенциал Электрохимические процессы - Это процессы взаимного превращения химической и электрической форм энергии. Их можно разделить на две...
-
Гальванический элемент. ЭДС гальванического элемента - Основы химии
Рассмотрим простейший гальванический элемент Даниэля - Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Термодинамика растворения. Растворение газов в жидкостях. Закон Генри. Давление пара растворов. Закон Рауля Молекулярным (истинным) раствором называется...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
Ионное произведение. Водородный показатель Электропроводность воды объясняется тем, что вода в очень малой степени диссоциирует, образуя ионы водорода и...
-
Растворы электролитов. Степень электрической диссоциации. Слабые электролиты. Константа диссоциации Растворы электролитов. Степень электрической...
-
Второе начало термодинамики. Энтропия Объединенное уравнение первого и второго начал термодинамики Рис. 12 Из выражения первого начала термодинамики U =...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Гомогенный и гетерогенный катализ - Систематика химических элементов
Вещества, увеличивающие скорость химической реакции, называются Катализаторами. Явление возрастания скорости реакции под действием таких веществ,...
-
Принцип Ле Шателье - Систематика химических элементов
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций и минимальному значению энергии Гиббса (G0Т=0), является наиболее...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Фазовое равновесие. Правило фаз. Диаграмма состояния однокомпонентной системы Гетерогенные равновесия, связанные с переходом веществ из одной фазы в...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
Кипение и замерзание растворов - Систематика химических элементов
Следствием снижения давления насыщенного пара растворителя над раствором является повышение температуры кипения по сравнению с чистым растворителем и...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Роберт Боиль - Становление понятия о химическом элементе
Боиль жил в эпоху великих общественных и духовных преобразований. Однако несмотря на сильные религиозные тенденции, Бойль научными работами расчистил...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Представления Дмитрия Ивановича Менделеева - Становление понятий о химическом элементе
Пребывание в Германии позволило Менделееву участвовать в уже ранее упоминавшемся конгрессе химиков в Карлструэ. На него, как и на Лотара Мейера, большое...
-
Роберт Бойль, Михаил Васильевич Ломоносов - Становление понятий о химическом элементе
Бойль жил в эпоху великих общественных и духовных преобразований. Однако несмотря на сильные религиозные тенденции, Бойль научными работами расчистил...
-
Дмитрий Иванович Менделеев - Становление понятия о химическом элементе
Пребывание в Германии позволило Менделееву участвовать в уже ранее упоминавшемся конгрессе химиков в Карлструэ. На него, как и на Лотара Мейера, большое...
-
Введение, Общая характеристика химического элемента, Физические свойства - Биогенные элементы. Сера
Семра -- элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16....
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Если атом находится в основном (т. е. в невозбужденном) состоянии, то его электроны занимают самые низкие по энергиям орбитали. Однако в многоэлектронном...
-
Основы химической термодинамики. Первое начало термодинамики Термодинамические системы и термодинамические параметры. Функции состояния. Парциальные...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Характеристика элемента - Химический элемент Магний
Название "магнезия" встречается уже в III веке н. э., хотя не вполне ясно, какое вещество оно обозначает. Долгое время магнезит - карбонат магния -...
-
Йенс Якоб Берцелиус - Становление понятия о химическом элементе
Особенно большое значение имели работы шведского химика Берцелиуса, который дал более точные определения атомных масс. Уже до Берцелиуса Дальтон...
Гальванический элемент Даниэля-Якоби. Электродвижущая сила элемента - Систематика химических элементов