Реакции обнаружения анионов, Первая группа анионов, Борат - Свойства и формы содержания анионов металлов I аналитической группы
Анионы образуются Р-элементами, т. е. элементами IV - VII групп 2-, 3-, 4- и реже 5- и 6-го периодов периодической системы элементов. В растворах в виде анионов могут быть бор - элемент III группы 2-го периода и ионы переходных элементов (D-элементы) в их высших степенях окисления. Один и тот же элемент может образовать несколько анионов с различными свойствами, например, Сl-, СlO -, СlО 3-, СlO4-.
В основу классификаций анионов положены их окислительно-восстановительные свойства, отношение анионов к Ag(I), Ва(II), Са(II), способность образовывать газообразные вещества при действии кислот и т. д. Ниже приведена классификация анионов, основанная на различной растворимости солей бария и серебра:
|
Номер группы |
Анионы |
|
I |
B(OH)4-, CO3 2-, SiO32-, Po43-, AsO33-, AsO43-, SO42-, SO32-, S2O3-, F- |
|
II |
S2-, CL-, Br-, I, IO3-, SCN- |
|
III |
NO3-, NO2-, CY3COO- |
Первая группа анионов
Борат
Борная кислота Н3ВО3 - белое кристаллическое вещество, в котором существуют структурные единицы В(ОН)3, связанные между собой водородными связями с образованием слоев почти гексагональной симметрии. Она хорошо растворима в воде. Кислота очень слабая: РКА,1 =9,24. В растворе устанавливается равновесие:
При концентрации H3BO3 ? S 0,025 М в растворе присутствуют только В(ОН)3 и В(ОН)4-. При больших концентрациях Н3ВО3 Кислотность увеличивается вследствие образования полимерных частиц: рКA,1=6,84:
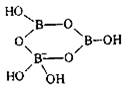
ЗВ(ОН)3=В3О3(ОН)4- + Н + +ЗН2О
Соединение В3О3(ОН)4- - циклический полимер
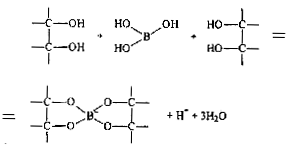
Силу борной кислоты можно увеличить добавлением полиоксо соединений (глицерин, маннит); тогда образуются хелаты - циклические эфиры ортоборной кислоты:
Гидратированные бораты, например Na2B4O7-10H2O, содержат в кристалле полианионы, но не все известные полианионы существуют в растворе. Анион В4О72- взаимодействует с водой:
Растворимы в воде только бораты щелочных металлов. Нерастворимые в воде бораты растворяются в кислотах. Борат серебра растворим в NH3.
1. Окрашивание пламени. Летучие соединения бора (Н3ВО3, BF3, эфиры Н3ВО3), окрашивают пламя горелки в зеленый цвет.
Большинство боратов разлагаются концентрированной H2SO4 С выделением летучей Н3ВО3. Реакцию проводят в ушке платиновой или нихромовой проволоки. Предел обнаружения бора 0,2 - 0,3 мкг. Мешают соли Ва, Сu и Тl, а также фосфаты и молибдаты. В присутствии РО43 образуется нелетучее соединение (ВО)РО3. Молибдаты образуют нелетучий 12-молибдоборат. В присутствии CaF2 и концентрированной H2SO4 или K2S2O7 Бораты дают легколетучий трифторид бора BF3 (т. кип. 101 °С). Переведение бора в борноэтиловый или борнометиловый эфир позволяет значительно повысить избирательность реакции обнаружения бора. При действии на сухой борат натрия концентрированной H2SO4 и этанола (или метанола) образуется борноэтиловый (борнометиловый) эфир:
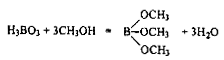
(т. пл. 29 °С, т. кип. 69 °С). Предел обнаружения бора - 7,6 мкг. Можно обнаружить борат-ион в присутствии всех анионов. Если в испытуемом растворе присутствуют Ва(II) или Cu(II), борат-ион обнаруживают в содовой вытяжке.
Предполагают, что зеленое свечение пламени обусловлено присутствием радикала ВО 2.
2. Хинализарин в присутствии концентрированной H2SO4 образует с борной кислотой окрашенное в синий цвет соединение:
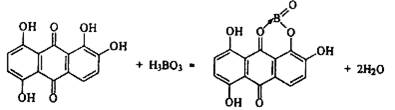
Предел обнаружения бората - 0,06 мкг. Мешают окрашенные ионы (Fe(III), Сu(II), Ni(II), Cr(III) и др.), Sb(IH) (так как образует аналогичное соединение с хинализарином), большие количества I- из-за выделения I2, окрашенного в бурый цвет.
Похожие статьи
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Методы анализа - Свойства флавоноидов
Качественное определение. Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и...
-
Алюминаты. Алюминатные растворы - Алюминий и его свойства
Оксид алюминия - соединение амфотерное, т. е. обладающее одновременно основными и кислотными свойствами. Поэтому оксид, а также его гидроксиды...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
NаСl + NН4НСО3 NаНСО3 + NН4Сl Равновесие которой почти нацело смещено вправо (вследствии очень малой растворимости NаНСО3 в растворе NН4Сl)....
-
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
По химическим свойствам галлий сходен с алюминием. На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком,...
-
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Твердый, хрупкий, блестяще-черный полуметалл. Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем...
-
При кипячении с разведенной хлороводородной кислотой происходит процесс гидролиза с образованием бензгидрола: Обнаружение димедрола методом ТСХ....
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
ДОПОЛНИТЕЛЬНЫЙ ОПЫТ. ПЕРИОДИЧЕСКАЯ РЕАКЦИЯ - Свойства галогенов
Приготовить в двух отдельных стаканчиках раствор 0,72 г иодата калия в 8 мл 2%-ной хлорной кислоты и раствор 0,3 г малоновой кислоты, 0,1 г сульфата...
-
Физические свойства Таллия - Третья группа периодической системы
. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет...
-
Механизм реакции, Растворители - Окисление по Байеру-Виллигеру
В 1948 г. Криге предположил, что реакция Байера-Виллигера протекает по ионному механизму. Первая стадия этого процесса, по-видимому, заключается в...
-
Способы получения и химические свойства кислот - Основы химии
Бескислородные кислоты получают: 1. Взаимодействием неметалла с водородом. Например H2 + Cl = 2HCl 2. Действием на соль более сильной или менее летучей...
-
Получение, Изотопы, Физические свойства, Химические свойства - Краткие сведения о кобальте
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для...
-
Алюминий - самый распространенный в земной коре металл. На его долю приходится 5,5-6,6 мол. доли % или 8 масс. %. Главная масса его сосредоточена в...
-
Химические свойства, Физиологическое воздействие - Золото
Золото -- самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством...
-
Характеристика ионов хрома - Оценка показателей количественного содержания хрома в реке Москва
Соединения хрома являются тяжелыми металлами, в поверхностные воды попадают при выщелачивании из пород, некоторые количества поступают из почв в процессе...
-
На воздухе галлий устойчив при обычной температуре, так как покрывается, подобно алюминию, прочной оксидной пленкой. Выше 260 C в сухом кислороде...
-
Образование фенолятов, Реакции ароматического ядра фенолов - Спирты и фенолы
Образование простых эфиров фенолов алкилированием фенолятов: ArONa + RI > ArOR + NaI ArONa + (CH3O)2SO2 > ArOCH3 + CH3O-SO2ONa Образование...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Физические и химические свойства - Мышьяк, висмут и сурьма
Сурьма известна в кристаллической форме и трех аморфных модификациях (взрывчатая, черная и желтая). По внешнему виду кристаллическая, или серая, сурьма...
-
Химические свойства - Свойства азота
Азот находиться в верхнем правом углу периодической системы, в котором сосредоточены неметаллы с наибольшими сродствами к электронам. Поэтому он должен...
-
Оценка содержания висмута в организме проводится по результатам исследований биосубстратов - мочи, крови и биоптатов. При хронической интоксикации...
-
Физические свойства, Общая химическая характеристика кадмия - История открытия и свойства кадмия
Кадмий _ Серебристо-белый , отливающий синевой Металл , тускнеющий на воздухе из-за образования защитной пленки оксида. Температура плавления - 321C,...
-
Определение мышьяка., Свойства мышьяка - Мышьяк, висмут и сурьма
Качественной реакцией на мышьяк является осаждение желтого сульфида As2S3 из солянокислых растворов. Следы определяют реакцией Марша или методом...
-
Строение и физико-химические свойства аскорбиновой кислоты - Аскорбиновая кислота
Аскорбиновая кислота (Acidumascorbinicum) - это белые кристаллы с резким кислым вкусом. Молекулярная масса = 176,13. Температура плавления аскорбиновой...
-
Теллур - Химия элементов VI группы
Теллур -- химический элемент 16-й группы, 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium) . Атом...
-
Галогениды германия - Свойства германия
Кремний и германий образуют галогениды состава Э(Hal)4 со всеми галогенами (Hal = F, Cl, Br, I). В обычных условиях ЭF4 - газы, ЭCl4 - жидкости, а ЭBr4 и...
-
Германиевая кислота, Водородные соединения германия - Свойства германия
H4GeO4 (H2GeO3-H2O) - метагерманиевая кислота. В свободном виде (как и мономерные кислородные кислоты углерода и кремния) не получена. При подкислении...
-
Введение, Общая характеристика химического элемента, Физические свойства - Биогенные элементы. Сера
Семра -- элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16....
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
Реакции обнаружения анионов, Первая группа анионов, Борат - Свойства и формы содержания анионов металлов I аналитической группы