Потенциалы металлических электродов, Стандартный водородный потенциал. Водородная шкала потенциалов, Потенциал металлического электрода - Систематика химических элементов
Стандартный водородный потенциал. Водородная шкала потенциалов
ЭДС гальванического элемента равна разности равновесных потенциалов электродов:
EЭ = цК - цА,
Где К - Потенциал катода; А - потенциал анода.
Если потенциал одного из электродов принять равным нулю, то относительный потенциал второго электрода будет равен ЭДС элемента.
В настоящее время за ноль принят потенциал водородного электрода. Электрод выполнен из платинированной платины, контактирующей с газообразным водородом, находящимся при давлении 101кПа и раствором, в котором активность катионов водорода Н+ равна единице.
Для определения потенциала электрода по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым - стандартный водородный электрод:
Н2, Рt |H+ | | Zn2+ | Zn
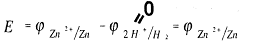
ЭДС этого элемента будет равна потенциалу цинкового электрода:
Токообразующей реакцей в этом элементе будет следующая реакция:
Zn + 2H2+ = Zn2+ + H2.
Потенциал металлического электрода
При погружении металла в раствор собственных ионов устанавливается следующее равновесие:
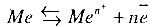
При равновесии растворение металла равно скорости разряда его ионов.
Потенциал, который устанавливается на электроде при равновесии, называется Равновесным потенциалом. Для его измерения необходим гальванический элемент следующего вида:
H2, Рt | H+ | | MeN+ | Me,
В котором токообразующая реакция будет реакцией следующего типа:
MeN+ + n/2Н = Me + nH+.
ЭДС этого элемента будет равна потенциалу электрода по водородной шкале:
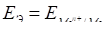
.
Поскольку [Н+]= 1, р(H2) = 1, то
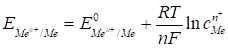
. (62)
Уравнение (62) называется Уравнением Нернста. Переходя от натурального логарифма к десятичному и подставляя во второе слагаемое температуру Т=298К и соответствующие значения R и F, получим расчетную форму уравнения Нернста:
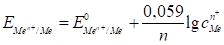
.
Стандартный электродный потенциал металла указывает на меру восстановительной способности его атомов и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он характеризуется. Чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы.
Похожие статьи
-
Электрохимические процессы, Электродный потенциал - Систематика химических элементов
Электродный потенциал Электрохимические процессы - Это процессы взаимного превращения химической и электрической форм энергии. Их можно разделить на две...
-
Гальванический элемент Даниэля-Якоби Гальванический элемент Даниэля-Якоби состоит из двух электродов, которые находятся в растворах собственных ионов, в...
-
Ионное произведение. Водородный показатель Электропроводность воды объясняется тем, что вода в очень малой степени диссоциирует, образуя ионы водорода и...
-
Теплота образования. Теплота сгорания. Следствия из закона Гесса - Систематика химических элементов
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
Термодинамика растворения. Растворение газов в жидкостях. Закон Генри. Давление пара растворов. Закон Рауля Молекулярным (истинным) раствором называется...
-
Второе начало термодинамики. Энтропия Объединенное уравнение первого и второго начал термодинамики Рис. 12 Из выражения первого начала термодинамики U =...
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Гальванический элемент. ЭДС гальванического элемента - Основы химии
Рассмотрим простейший гальванический элемент Даниэля - Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Свободная энергия Гельмгольца. Свободная энергия Гиббса - Систематика химических элементов
Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые...
-
Фазовое равновесие. Правило фаз. Диаграмма состояния однокомпонентной системы Гетерогенные равновесия, связанные с переходом веществ из одной фазы в...
-
Принцип Ле Шателье - Систематика химических элементов
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций и минимальному значению энергии Гиббса (G0Т=0), является наиболее...
-
Гомогенный и гетерогенный катализ - Систематика химических элементов
Вещества, увеличивающие скорость химической реакции, называются Катализаторами. Явление возрастания скорости реакции под действием таких веществ,...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Химические свойства Магния. - Химический элемент Магний
Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина,...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов...
-
Кипение и замерзание растворов - Систематика химических элементов
Следствием снижения давления насыщенного пара растворителя над раствором является повышение температуры кипения по сравнению с чистым растворителем и...
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Термодинамика. Химическая термодинамика. Термодинамические системы. Энергия. Внутренняя энергия Термодинамика изучает взаимное превращение теплоты,...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Стандартные методы, как правило, предусматривают использование количественного анализа, позволяющего установить точное содержание отдельных элементов и...
-
Правила определения степени окисления элемента - Окислительно-восстановительные процессы
Степень окисления - это условный заряд, который приписывается атому При допущении, что все связи в веществе являются Ионными. Известно, что чисто ионной...
-
Теплота. Работа. Первое начало термодинамики - Систематика химических элементов
Все изменения внутренней энергии при ее переходе от одной системы к другой можно разбить на две группы. В первую группу входят формы перехода энергии за...
-
Растворы электролитов. Степень электрической диссоциации. Слабые электролиты. Константа диссоциации Растворы электролитов. Степень электрической...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Получение., Применение. - Свойства фтора как химического элемента
Источником для производства фтора служит фтористый водород, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при...
-
Магнийорганические соединения. - Химический элемент Магний
Соединения магния с органическими кислотами. Ацетат магния Mg(CH3COO)2 - хорошо растворимое в воде соединение. Оксалат магния MgC2O4 - труднорастворимое...
-
ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Легкий, мягкий, быстро окисляющийся металл серебристо-белого цвета Алюминий -- очень активный металл. В ряду напряжений он стоит после щелочных и...
-
Роберт Бойль, Михаил Васильевич Ломоносов - Становление понятий о химическом элементе
Бойль жил в эпоху великих общественных и духовных преобразований. Однако несмотря на сильные религиозные тенденции, Бойль научными работами расчистил...
Потенциалы металлических электродов, Стандартный водородный потенциал. Водородная шкала потенциалов, Потенциал металлического электрода - Систематика химических элементов