Метод валентных связей - Типы химических связей. Ковалентная связь
Основные положения:
- 1. Ковалентная связь - образуется за счет 2-х электронов с антипараллельными спинами. Эта общая электронная пара принадлежит обоим атомам, она называется поделенной или связывающей парой. Комбинация таких 2-хэлектр-х 2-хцентровых связей - называется валентной схемой. 2. Прочность ковалентной связи тем больше, чем больше степень перекрывания электронных облаков. 3. Число химических связей определяется числом общих электронных пар. 4. Строение молекулы определяется Направлением в пространстве атомных орбиталей, которые участвуют в образовании химической связи. 5. Ковалентная связь характеризуется насыщаемостью, направленностью, полярностью. 6. В зависимости от симметрии орбиталей, различают сигма-, пи - и дельта-связи.
У-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность находится в межъядерном пространстве.
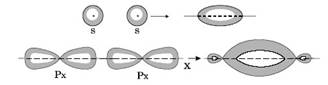
Рис.1. Некоторые примеры образования у-связей
Р - связь возникает при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Суммарные электронные облака также симметрично располагаются относительно этой линии.
Д-связь могут образовывать только d-электроны за счет перекрывания всех четырех своих лепестков электронных облаков, расположенных в параллельных плоскостях.
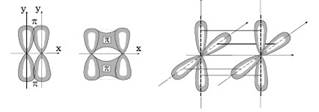
Рис.2. Примеры р - и д - связей.
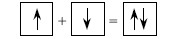
Существуют различные Механизмы образования общей электронной пары. Первый - называется Обменным механизмом, Он заключается в спаривании двух электронов, которые принадлежат разным атомам и имеют противоположные спины. Это можно отразить следующей схемой:
Донорно-акцепторный механизм образования ковалентной связи - за счет электронной пары из внешнего энергетического уровня одного атома и свободной орбитали другого атома. Так образуется ион аммония или молекула СО. Атом, предоставляющий электронную пару, называется Донором, а атом, имеющий свободную орбиталь - Акцептором. Схему образования связи в этом случае можно представить так:
Похожие статьи
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Методы определения корреляционной связи - Корреляционно-регрессионный анализ
Корреляцию и регрессию принято рассматривать как совокупный процесс статистического исследования, поэтому их использование в статистике часто именуют...
-
Химическая связь и валентность, Валентность - Квантовые концепции в химии
Валентность Валентность - это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Химические свойства. Образование ковалентной связи по донорно-акцепторному механизму - Аммиак
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус - синий; фенолфталеин - малиновый)...
-
В этой работе описаны общая характеристика пероксидов щелочных металлов, их химические и физические свойства, а также их получение. Особое внимание...
-
Методы изучения связи качественных признаков - Основы эконометрики
При наличии соотношения между вариацией качественных признаков говорят об их ассоциации, взаимосвязанности. Для оценки связи в этом случае используют ряд...
-
Химическая связь и строение молекул вещества. - Роль химии в повседневной жизни
Атомистические воззрения возникли первоначально на Древнем Востоке, в античных Греции и Риме. Первоначально атомное учение предполагало существование...
-
Физические свойства. Очень чистые вещества бесцветные и очень устойчивые соединения. Получение: Диоксид щелочного металла получают путем быстрого...
-
Физические свойства Очень чистый Na2O2 бесцветен, обычно полученный продукт чуть желтоватого цвета. Tпл = 6750 c (разлагается). Гексагональная...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
APCI также стала важным способом ионизации, потому что она генерирует ионы непосредственно из раствора, и способна к анализу относительно неполярных...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Рассмотрим теперь, какое влияние на свойства веществ оказывает порядок соединения атомов в молекуле. Обратимся сначала к историческим фактам. Изучая...
-
Важной задачей статистики является разработка методики статистической оценки социально-экономических явлений, которая осложняется тем, что многие...
-
Частным случаем недетерминированной связи является связь случайная - стохастическая (вероятностная). Реализация вероятностного подхода к описанию...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Собственно-корреляционные параметрические методы изучения связи - Основы эконометрики
Измерение тесноты и направления связи является важной задачей изучения и количественного измерения взаимосвязи социально-экономических явлений. Оценка...
-
Разработав теорию и подтвердив правильность ее синтезом новых соединений, А. М. Вутлеров не считал теорию абсолютной и неизменной. Он утверждено, что она...
-
Основы новой теории сформулировал 1861 г. профессор Казанского университета Александр Бутлеров. В химии к тому времени уже значительное распространение...
-
Оценка содержания висмута в организме проводится по результатам исследований биосубстратов - мочи, крови и биоптатов. При хронической интоксикации...
-
Применение H2O2 связано с его окислительными свойствами и безвредностью продукта его восстановления (H2O). Его использую для отбеливания тканей и мехов,...
-
Дипольный момент молекулы и связи
Представим себе, что можно найти "центры тяжести" отрицательных и положительных частей молекулы. Тогда условно все вещества можно разбить на две группы....
-
Водородные соединения, Водородная связь - Свойства водорода
В этой таблице слева легкой тенью выделены клетки элементов, образующих с водородом ионные соединения - гидриды. Эти вещества имеют в своем составе...
-
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
Химические свойства - Свойства азота
Азот находиться в верхнем правом углу периодической системы, в котором сосредоточены неметаллы с наибольшими сродствами к электронам. Поэтому он должен...
-
Модель Лефевра-Николиса описывает колебательные процессы в следующей цепочке химических реакций: Предполагается, что концентрации веществ A, B, D, E...
-
Стандартные методы, как правило, предусматривают использование количественного анализа, позволяющего установить точное содержание отдельных элементов и...
-
ВВЕДЕНИЕ, СТРОЕНИЕ МОЛЕКУЛ И СВОЙСТВА ВОДЫ - Химические свойства и строение воды
Вода - ценнейший природный ресурс. Вода играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Исходные коды программы - Автоколебания в химических реакциях. Численные методы
MainUnit. h //--------------------------------------------------------------------------- #ifndefMainUnitH #define MainUnitH...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
Метод валентных связей - Типы химических связей. Ковалентная связь